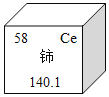
题目内容
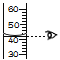
【题目】小明在实验室用氯酸钾和二氧化锰制取氧气,测得的反应中固体总质量随时间变化如下图所示,请回答:
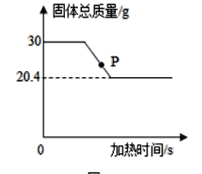
(1)完全反应时生成的氧气质量是_____g。
(2)计算原固体中的氯酸钾和二氧化锰的质量各是多少?_____(写出计算过程)
(3)请分析图中P点时剩余固体的成分_____。
【答案】9.6 24.5g;5.5g KClO3、MnO2、KCl或:氯酸钾、二氧化锰、氯化钾
【解析】
(1)由质量守恒定律可知,固体减少的质量即为反应生成的氧气质量,氧气质量为:30g-20.4g=9.6g;
(2)原固体中的氯酸钾全部分解,设原固体中的氯酸钾的质量为x,则
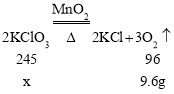
![]()
解得x=24.5g;
原固体中的二氧化锰的质量为30g-24.5g=5.5g。
答:原固体中的氯酸钾和二氧化锰的质量分别是24.5g、5.5g。
(3)由图象可知,P点所示固体的质量还在继续减少,即氯酸钾还没有完全分解,所以P点处的物质有氯酸钾(![]() )、二氧化锰(
)、二氧化锰(![]() )和氯化钾(
)和氯化钾(![]() )。
)。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目