题目内容
【题目】元素周期表是学习和研究化学的重要工具。请回答下列问题:
(1)元素周期表中不同元素间最本质的区别是(填字母)。
A.中子数不同
B.质子数不同
C.电子层数不同
(2)下图是某反应的微观示意图。
请回答:
Ⅰ.B框中的物质属于(填序号:“①化合物、②单质、③纯净物、④混合物”中的两项)。
Ⅱ.写出该反应的化学方程式 , 该反应氧化反应(填“属于”“不属于”之一),该反应前后硫元素的化合价(填“不变”“升高”“降低”之一)。
【答案】
(1)B
(2)②③,2H2S+3O2 ![]() 2SO2+2H2O,属于,升高
2SO2+2H2O,属于,升高
【解析】(1)决定元素种类的是质子数不同或核电荷数不同,所以不同元素间最本质的区别是质子数不同;
(2)由物质的微观构成可知,反应物是硫化氢和氧气,硫化氢燃烧生成水和二氧化硫,即生成物是水和二氧化硫,因此
Ⅰ.B框中的物质为氧气,是同种原子构成的分子,属于单质,单质属于纯净物;
Ⅱ.根据分析该反应是硫化氢和氧气点燃生成水和二氧化硫,去掉一个没有参加反应的氧气分子,微粒个数比为2:3:2:2,方程式为:2H2S+3O2![]() 2SO2+2H2O;属于置换反应,在H2S、S中硫的化合价分别是-2,0.所以该反应前后硫元素的化合价升高;
2SO2+2H2O;属于置换反应,在H2S、S中硫的化合价分别是-2,0.所以该反应前后硫元素的化合价升高;
所以答案是:(1)B;(2)②③;2H2S+3O2![]() 2SO2+2H2O;属于;升高.
2SO2+2H2O;属于;升高.
【考点精析】本题主要考查了单质和化合物的判别的相关知识点,需要掌握单质与化合物的区别:单质是由同一种元素组成的纯净物.只含有一种元素的物质,但必须是纯净物;化和物:是由不同种元素组成的纯净物才能正确解答此题.

 名校课堂系列答案
名校课堂系列答案【题目】实验室中有一瓶含有少量氯化钠和可溶性杂质的硫酸钠样品.某化学兴趣小组对该样品成分进行定量测定,甲、乙、丙三位同学分别称取一定质量的样品放入烧杯中,溶入足量水后过滤得到滤液;再向滤液中加入一定质量的氯化钡溶液,充分反应后过滤,将沉淀洗涤、干燥并称量.相关实验数据记录如下:(Na2SO4+BaCl2=BaSO4↓+2NaCl)
称量项目 | 甲 | 乙 | 丙 |
所取样品的质量/g | 15 | 15 | 20 |
加入氯化钡溶液的质量/g | 150 | 100 | 100 |
反应后所得沉淀的质量/g | 23.3 | 23.3 | 23.3 |
请回答下列问题:
(1)同学(选填“甲”“乙”或“丙”)所取用的样品与氯化钡溶液恰好完全反应.
(2)计算该样品中硫酸钠的质量分数.(写出计算步骤,计算结果保留到0.1%)
(3)若欲计算出样品与氯化钡溶液恰好完全反应时所得溶液的溶质质量分数,上述实验过程中还需要测定的数据是 .
【题目】兴趣小组分析了用硫铁矿烧渣(主要成份Fe2O3、Fe3O4、FeO等)制备铁红(Fe2O3) 的流程图并进行了铁红性质实验。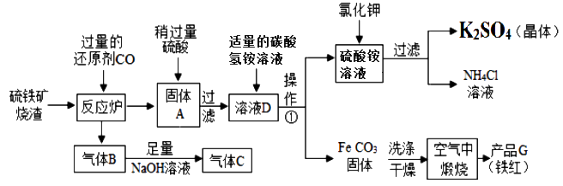
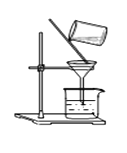
(1)实验室完成操作1,用到的铁制仪器是。
(2)你认为对气体C最佳的处理方法是。( )
A.冷却后排入空气
B.燃烧后排放
C.再通入反应炉
(3)在生成K2SO4的这个反应中,相关物质的溶解度如下表。
物质 | KCl | K2SO4 | NH4Cl | (NH4)2SO4 |
溶解度/g(20℃) | 34.2 | 11.1 | 37.2 | 75.4 |
你认为该反应在常温下能实现的原因是。
(4)洗涤干燥得到K2SO4晶体时,可选用下列(填字母)洗涤剂;
A.KCl的饱和溶液 B.水 C.K2SO4的饱和溶液
为检验K2SO4晶体是否洗涤干净,可取最后一次洗涤液,先加入(选填序号,下同),振荡、静置,再向上层清液中滴加 , 观察现象即可判断。(已知硫酸银在水中微溶,以沉淀形式存在)
A.AgNO3溶液 B.过量的BaCl2溶液 C.过量的Ba(NO3)2溶液
(5)在空气中煅烧FeCO3即FeCO3与空气中的氧气反应生成Fe2O3与CO2 , 试写出该反应的化学反应方程式为