题目内容
【题目】实验室中有一瓶含有少量氯化钠的硫酸钠样品。某化学兴趣小组对该样品成分进行定量测定,同学们称取样品15g放入烧杯中,加入180g水使其完全溶解,再加入100g氯化钡溶液恰好完全反应,过滤,得271.7g滤液(不考虑实验过程中质量的损失)。请回答下列问题:
(1)完全反应后所得沉淀的质量为_____g
(2)计算该样品中硫酸钠的质量分数。_____(写出计算步骤,计算结果保留到0.1%)
(3)样品与氯化钡溶液恰好完全反应时所得不饱和溶液的溶质质量分数为。_____(计算结果保留到0.1%)
【答案】23.3 94.7% 4.6%
【解析】
根据质量守恒定律可得,生成的硫酸钡的质量为15g+180g+100g-271.7g=23.3g
设样品中硫酸钠的质量为x,生成的氯化钠的质量为y
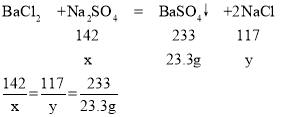
x=14.2g
y=11.7g
该样品中硫酸钠的质量分数为![]() ×100%≈94.7%
×100%≈94.7%
样品与氯化钡溶液恰好完全反应时所得不饱和溶液的溶质质量分数为![]() ×100%≈4.6%
×100%≈4.6%
答:(1)完全反应后所得沉淀的质量为 23.3g.
(2)该样品中硫酸钠的质量分数为94.7%.
(3)样品与氯化钡溶液恰好完全反应时所得不饱和溶液的溶质质量分数为 4.6%.

 名师指导期末冲刺卷系列答案
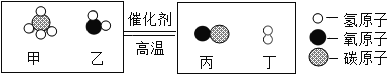
名师指导期末冲刺卷系列答案【题目】将一定量的乙醇C2H6O和氧气置于一个完全封闭的容器中引燃,测得反应前后物质的质量如下表。下列判断正确的是( )
物质 | C2H6O | O2 | CO2 | H2O | X |
反应前质量/g | 4.6 | 8 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 4.4 | 5.4 | m |
A.表中 m 的值为 3.8
B.X 可能是该反应的催化剂
C.X 可能含有氢元素
D.若起始时氧气的质量是 9.6g,则无 X 生成
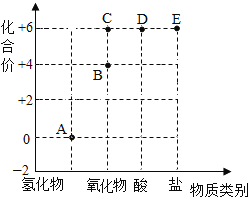
【题目】以化合价为纵坐标,以物质的类别为横坐标所绘制的图像叫价类图。如图为硫的价类图,例如E点可表示+6价的硫酸铜。请回答:
(1)A点对应物质的类别是________;请写出C点表示的物质化学式______。
(2)硫酸的化学式为H2SO4,它代表的点是___________(填字母);B点代表的物质能与H2S反应生成A点表示的物质和一种最常用的溶剂,写出该反应的化学方程式是____________。
(3)如图是测定空气中氧气含量实验的两套装置图,请结合图示回答有关问题。
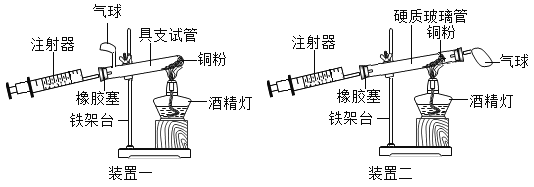
①根据下表提供的实验数据,完成下表。
硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
25 mL | 15 mL | 9 mL | ____________ |
②装置一和装置二中气球的位置不同,_______________ (填“装置一”或“装置二”)更合理,理由是________________。
③能否用硫粉替代铜粉测定空气中氧气的含量,请判断并说出你的理由_________。
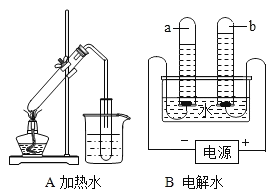
【题目】高锰酸钾在生产、生活中有广泛应用。实验小组对高锰酸钾的某些性质进行研究。
Ⅰ.不稳定性

(1)如右图所示进行实验,受热分解的化学方程式为,3.16g KMnO4产生O2的质量质量为 _____g。
(2)用向上排空气法收集O2的原因是__________。
Ⅱ.腐蚀性
【查阅资料】KMnO4 溶液呈中性、有腐蚀性
【进行实验】
实验1:将新鲜鸡皮在不同浓度的KMnO4溶液中浸泡相同时间,现象如下表
KMnO4 溶液浓度 | 0.002% | 0.01% | 0.1% | 1% |
鸡皮的变化 | 无明显变化 | 边缘部分变为棕黄色 | 全部变为棕色 | 全部变为黑色 |
实验2:将铜片分别浸泡在4种浸泡相同时间,现象如下表。
编号 | ① | ② | ③ | ④ | |||||
实验 |
25mL0.1%KMnO4溶液 |
25mL0.1%KMnO4溶液+10滴浓硫酸 |
25mL蒸馏水+10滴浓硫酸 |
25mL1%KMnO4溶液+10滴浓硫酸 | |||||
铜片 质量/g | 实验前 | 0.54 | 0.54 | 0.54 | 0.54 | ||||
18小时后 | 0.54 | 0.52 | 0.54 | 0.43 | |||||
【解释与结论】
(3)实验1的目的是____________________。
(4)实验2中通过对比②和④,得出的结论是________________。
(5)实验2中,欲得出“KMnO4和硫酸共同作用对铜才有腐蚀性”的结论,需要对比__________________(填编号)。
(6)实验2中,铜片被腐蚀的反应如下,补全该反应的化学方程式。
5Cu+2KMnO4+8H2SO4=5CuSO4+2MnSO4+K2SO4+□_________
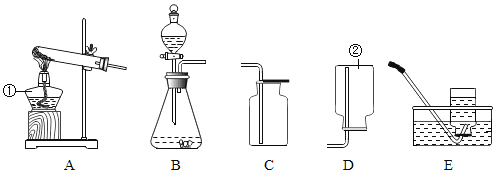
【题目】某班同学到实验室进行气体的制取实验,实验桌上摆放了下列仪器可供选用(铁架台省略)。
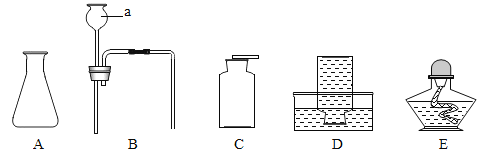
请回答下列问题:
⑴仪器a的名称是_______。
⑵组合一套制备并收集CO2的实验装置,应选用的仪器是______(填字母序号)。
⑶如果用制取二氧化碳的装置来制取氧气,则反应的化学方程式是________。
⑷阅读以下资料并回答:
物质 | 制取气体的药品 | 制取气体的反应条件 | 气体的物理性质 |
氯气 | 固体二氧化锰、液体浓盐酸 | 需要加热 | 密度比空气大、能溶于水 |
制取氯气_________(填“可以”或“不可以”)采用制取二氧化碳气体的发生装置,收集氯气可以选用的仪器是_________(填字母序号)。