题目内容
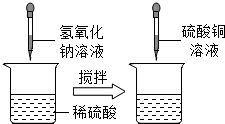 某同学做了如图所示实验:已知所用的三种溶液中溶质质量分数均为20%.且第二次和第三次所加物质最后都没有剩余.请回答下列问题:
某同学做了如图所示实验:已知所用的三种溶液中溶质质量分数均为20%.且第二次和第三次所加物质最后都没有剩余.请回答下列问题:(1)写出产生蓝色沉淀的化学方程式
(2)根据已知条件求第三次实验中生成沉淀的质量(X)的比例式
(3)第三次加入的氢氧化钠溶液质量n的数值是
(4)将第三次反应后的固态混合物过滤,向滤液中加入11.8g水,所得溶液中溶质的质量分数为
(5)若用98%的浓硫酸配置上述实验所需的稀硫酸,则应向需要的浓硫酸中加入水的质量是
| 第一次 | 第二次 | 第三次 | |
| 稀硫酸的质量 | m | m | m |
| 滴加氢氧化钠溶液的质量(g) | 60 | 100 | n |
| 滴加硫酸铜溶液的质量(g) | 40 | 40 | 80 |
| 实验现象 | 无明显现象 | 产生蓝色沉淀 | 产生蓝色沉淀 |
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)由实验现象可知,氢氧化钠和硫酸铜反应生成蓝色氢氧化铜沉淀和硫酸钠,根据化学方程式的要求正确书写;
(2)根据耗硫酸铜质量,利用化学方程式求第三次实验中生成沉淀的质量(X)的比例式;
(3)根据第二次和第三次所加物质最后都没有剩余,利用题中信息解答;
(4)根据溶质质量分数的公式解答;
(5)根据稀释前后溶质的质量不变分析
(2)根据耗硫酸铜质量,利用化学方程式求第三次实验中生成沉淀的质量(X)的比例式;
(3)根据第二次和第三次所加物质最后都没有剩余,利用题中信息解答;
(4)根据溶质质量分数的公式解答;
(5)根据稀释前后溶质的质量不变分析
解答:解:
(1)氢氧化钠和硫酸铜反应生成蓝色氢氧化铜沉淀和硫酸钠,产生蓝色沉淀的化学方程式为:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;
(2)设第三次实验中生成沉淀的质量为x,消耗氢氧化钠的质量为y,生成硫酸钠的质量为z,消耗硫酸铜质量为:80g×20%=16g,
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
80 160 98 142
y 16g x z
=
z=14.2g
=
x=9.8g
=
y=8g
消耗氢氧化钠溶液的质量为:
=40g
(3)80g硫酸铜溶液消耗40g氢氧化钠溶液,由于第二次和第三次所加物质最后都没有剩余,40g硫酸铜溶液消耗20g氢氧化钠溶液,第三次加入的氢氧化钠溶液质量n的数值是60g+20g+40g=120g
(4)由于第二次和第三次所加物质最后都没有剩余,40g硫酸铜溶液消耗20g氢氧化钠溶液,第二次中与硫酸反应的氢氧化钠溶液的质量为80g,
设消耗稀硫酸的质量为w,生成硫酸钠的质量为m
2NaOH+H2SO4=2H2O+Na2SO4
80 98 142
80g×20% w×20% m
=
w=98g
=
m=28.4g
第三次反应后的固态混合物过滤,向滤液中加入11.8g水,所得溶液中溶质的质量分数为:
×100%=14.2%
(5)设需要98%的浓硫酸的质量为M,得:
M×98%=98g×20%
M=20g
用98%的浓硫酸配置上述实验所需的稀硫酸,则应向需要的浓硫酸中加入水的质量是98g-20g=78g
答案:
(1)2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
(2)
=
(3)120
(4)14.2%
(5)78g
(1)氢氧化钠和硫酸铜反应生成蓝色氢氧化铜沉淀和硫酸钠,产生蓝色沉淀的化学方程式为:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;
(2)设第三次实验中生成沉淀的质量为x,消耗氢氧化钠的质量为y,生成硫酸钠的质量为z,消耗硫酸铜质量为:80g×20%=16g,
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
80 160 98 142
y 16g x z
| 160 |
| 142 |
| 16g |
| z |
z=14.2g
| 160 |
| 98 |
| 16g |
| x |
x=9.8g
| 80 |
| 160 |
| y |
| 16g |
消耗氢氧化钠溶液的质量为:
| 8g |
| 20% |
(3)80g硫酸铜溶液消耗40g氢氧化钠溶液,由于第二次和第三次所加物质最后都没有剩余,40g硫酸铜溶液消耗20g氢氧化钠溶液,第三次加入的氢氧化钠溶液质量n的数值是60g+20g+40g=120g
(4)由于第二次和第三次所加物质最后都没有剩余,40g硫酸铜溶液消耗20g氢氧化钠溶液,第二次中与硫酸反应的氢氧化钠溶液的质量为80g,
设消耗稀硫酸的质量为w,生成硫酸钠的质量为m
2NaOH+H2SO4=2H2O+Na2SO4
80 98 142
80g×20% w×20% m
| 80 |
| 98 |
| 80g×20% |
| w×20% |
w=98g
| 80 |
| 142 |
| 80g×20% |
| m |
m=28.4g
第三次反应后的固态混合物过滤,向滤液中加入11.8g水,所得溶液中溶质的质量分数为:
| 14.2g+28.4g |
| 12og+80g+98g-9.8g+11.8g |
(5)设需要98%的浓硫酸的质量为M,得:
M×98%=98g×20%
M=20g
用98%的浓硫酸配置上述实验所需的稀硫酸,则应向需要的浓硫酸中加入水的质量是98g-20g=78g
答案:
(1)2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
(2)
| 160 |
| 98 |
| 16g |
| x |
(3)120
(4)14.2%
(5)78g
点评:本题难度很大,即考查了化学方程式的书写,有考查了根据化学方程式的计算、反应后溶液中溶质质量分数的计算、稀释问题等,需逐步分析细心解答.

练习册系列答案
相关题目
构成下列物质的微粒是分子的是( )
| A、镁 | B、氯化钠 | C、液氧 | D、氖气 |
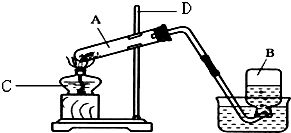 如图是某同学设计的实验室制取氧气的装置图.
如图是某同学设计的实验室制取氧气的装置图.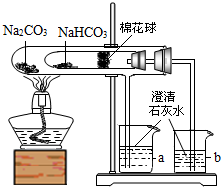 某化学兴趣小组的同学在学习了纯碱(Na2CO3)的性质后,联想到家中蒸制馒头时常用的物质小苏打(NaHCO3),于是采用市售的小苏打样品进行了如下实验探究碳酸氢钠的化学性质
某化学兴趣小组的同学在学习了纯碱(Na2CO3)的性质后,联想到家中蒸制馒头时常用的物质小苏打(NaHCO3),于是采用市售的小苏打样品进行了如下实验探究碳酸氢钠的化学性质