题目内容
【题目】化学小组同学探究“酸的化学性质”,请你参与并完成下列部分实验内容。
实验过程 | 实验现象 | 实验结论 |
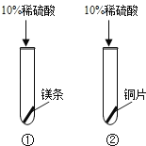
(1)
| ①号试管:固体溶解,产生气泡,放热; ②号试管: 。 | a、金属活动性: 镁 铜(填“>”或“<”) b、涉及到的化学方程式 。 |
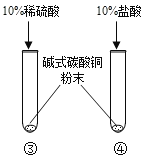
(2)
| ③号试管:绿色粉末逐渐溶解,产生气泡,溶液显蓝色。 ④号试管:绿色粉末逐渐溶解,产生气泡,溶液显绿色。 | Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑ Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑ |
【发现问题】碱式碳酸铜与稀硫酸反应形成的CuSO4溶液显蓝色,而与盐酸反应形成的CuCl2溶液显绿色。
【提出问题】同样都含有Cu2+,为什么③号试管中的CuSO4溶液显蓝色,而④号试管中的CuCl2溶液显绿色。
【猜想与假设】猜想一:若溶液中Cu2+显蓝色,则SO42+对Cu2+显色无影响,而Cl﹣对Cu2+显色有影响;
猜想二:若溶液中Cu2+显绿色,则 ;
猜想三:…
【实验验证】同学们用下列两种不同方案初步验证猜想一,请你补全实验所需试剂:
方案一:取少量③号试管中的溶液于另一支试管中,向其中加入 ,观察到预期实验现象,猜想一正确。
方案二:取少量④号试管中的CuCl2溶液于另一支试管中,向其中加入 ,观察到预期实验现象,猜想一正确。
【评价与反思】同学们在实验探究的过程中,体会到了溶液颜色成因复杂,相关知识还有待进一步学习。
【答案】【进行实验】无明显现象;>;Mg+H2SO4=MgSO4+H2↑;
【猜想与假设】SO42﹣对Cu2+显色有影响,而Cl﹣对Cu2+显色无影响;
【实验验证】适量的氯化钡溶液;适量的硝酸银溶液;(其它合理答案也可)。
【解析】
试题分析:【进行实验】因为铜排在氢的后面不能和酸反应,因此无现象;因为镁能够和硫酸反应产生氢气,说明排在氢的前面,故镁>铜;镁和硫酸反应的方程式为:Mg+H2SO4=MgSO4+H2↑;
【猜想与假设】根据猜想一,因此可以提出与之不同的猜想为:SO42﹣对Cu2+显色有影响,而Cl﹣对Cu2+显色无影响;
【实验验证】③号试管中含有的是硫酸根离子,因此可加入氯化钡等溶液使硫酸根离子产生沉淀,结果溶液由蓝色变成绿色,说明SO42+对Cu2+显色无影响,而Cl﹣对Cu2+显色有影响;
④号试管中含有的是氯离子,加入硝酸银溶液后氯离子变成沉淀,结果溶液绿色消失变成蓝色,说明SO42+对Cu2+显色无影响,而Cl﹣对Cu2+显色有影响。

 阅读快车系列答案
阅读快车系列答案