题目内容
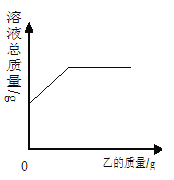
【题目】在一定质量的甲溶液中逐渐加入乙至过量,充分反应过程中溶液的总质量与加入乙的质量关系,能用下图曲线表示的是
序号 | 甲 | 乙 |
① | H2SO4溶液 | NaOH溶液 |
② | HCl溶液 | CuO粉末 |
③ | BaCl2溶液 | Na2CO3溶液 |
④ | H2SO4溶液 | 锌粒 |
A.仅①② B.仅②④ C.②③④ D.①②④
【答案】B
【解析】
试题分析:溶液质量=溶质质量+溶剂质量。①H2SO4溶液逐渐加入NaOH溶液至过量,H2SO4与NaOH反应生成硫酸钠(溶)和水,溶液质量会一直增加,不能;② HCl溶液逐渐加入CuO粉末(不溶)至过量,HCl 与CuO反应生成CuCl2(溶)和水,质量先增加,但HCl反应完全后,继续加入CuO粉末溶液质量也不再增加,能;③BaCl2溶液逐渐加入Na2CO3溶液至过量,BaCl2与Na2CO3反应生成NaCl(溶)和Ba CO3(不溶),那么反应发生时溶液质量是减小的,等BaCl2完;④H2SO4溶液逐渐加入锌粒(不溶),H2SO4与锌粒反应生成硫酸锌(溶)与氢气(不溶),那么反应发生时溶液质量是增大的,等H2SO4全反应后,继续加入锌粒溶液质量不变,能;综上能的是②④。

练习册系列答案
相关题目