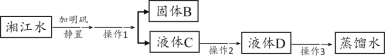题目内容
【题目】钨是熔点最高的金属,广泛用于钢铁工业、电真空照明材料等行业。黑钨矿的主要成分是铁和锰的钨酸盐(化学式为FeWO4、MnWO4),已知钨酸是一种难溶性酸,对热不稳定。用黑钨矿制取钨的工艺流程如下图所示:
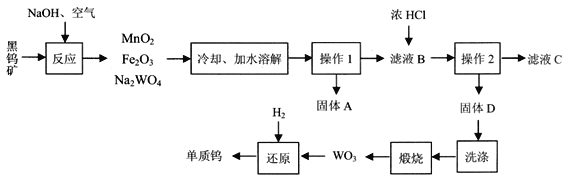
(1)FeWO4的名称是_____,钨酸的化学式为_____。
(2)如果在实验室里完成“操作1”,需要用到的玻璃仪器除漏斗、烧杯外,还有_____。
(3)“滤液B”中的主要离子是_____(填离子符号),“滤液B与浓盐酸反应的化学方程式为_____。
(4)H2在高温条件下还原三氧化钨(WO3)的化学方程式为_____。
(5)假设“滤液B”中的溶质的质量是aKg,那么,理论上可得到单质钨的质量是_____Kg(用含a的式子表示)。
【答案】钨酸亚铁 H2WO4 玻璃棒 Na+、WO42- Na2WO4 + 2HCl= 2NaCl+ H2WO4↓ WO3 + 3H2![]() 3H2O + W
3H2O + W ![]()
【解析】
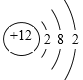
(1)根据流程图中化学式Na2WO4和化合价规律可知,原子团WO4显-2价,则FeWO4中铁元素的化合价为+2价,根据盐的命名规则,FeWO4的名称是钨酸亚铁;钨酸的化学式为H2WO4;
(2)根据流程图可知,操作1是将固体与液体分离,操作1是过滤。如果在实验室里完成“操作1”,需要用到的玻璃仪器除漏斗、烧杯外,还有玻璃棒;
(3)MnO2和Fe2O3不溶于水,Na2WO4 是一种钠盐,能溶于水,在水中电离出Na+和WO42-。“滤液B”中的主要离子是Na+、WO42-,“滤液B与浓盐酸相互交换成分反应生成氯化钠和钨酸的沉淀,反应的化学方程式为Na2WO4 + 2HCl= 2NaCl+ H2WO4↓;
(4)H2在高温条件下还原三氧化钨(WO3)生成钨和水,反应的化学方程式为WO3 + 3H2![]() 3H2O + W;
3H2O + W;
(5)设:理论上可得到单质钨的质量是x。
根据化学方程式Na2WO4 + 2HCl= 2NaCl+ H2WO4↓,H2WO4![]() WO3 + H2O ,WO3 + 3H2
WO3 + H2O ,WO3 + 3H2![]() 3H2O + W可得:
3H2O + W可得: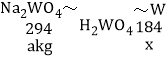
![]() x=
x=![]()

 教学练新同步练习系列答案
教学练新同步练习系列答案【题目】分析处理图表信息是学习的一种重要方法。如表是氯化钠、硝酸钾、氢氧化钙在不同温度下的溶解度。这三种固体物质的溶解度曲线如图所示。
温度/℃ | 20 | 40 | 60 | 80 | |
溶解度/g | NaCl | 36.0 | 36.6 | 37.3 | 38.4 |
KNO3 | 31.6 | 63.9 | 110 | 169 | |
Ca(OH)2 | 0.16 | 0.14 | 0.12 | 0.095 | |
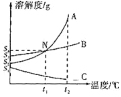
请仔细阅读图表后回答下列问题:
(1)A曲线表示的是_____的溶解度曲线。
(2)除去A中少量的B,步骤是:加水溶解,蒸发浓缩,_____,过滤,洗涤,干燥。
(3)20℃时,将氯化钠、硝酸钾、氢氧化钙各10g分别加入盛有50g水的烧杯中,充分溶解,测得三种溶液中溶质的质量分数分别为a%、b%、c%,则三者之间的大小关系是_____。
(4)现有一杯饱和溶液,是A、B、C三种饱和溶液中的一种,将其加热时出现浑浊现象,则这杯饱和溶液的溶质是_____。