题目内容
 为测定某纯碱(Na2CO3)样品中(含有少量的氯化钠杂质)碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(产生的气体全部逸出).产生气体的质量与滴入稀盐酸的质量关系如图所示,试计算:
为测定某纯碱(Na2CO3)样品中(含有少量的氯化钠杂质)碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(产生的气体全部逸出).产生气体的质量与滴入稀盐酸的质量关系如图所示,试计算:(1)A点产生气体的质量为______;B点对应溶液中所含的溶质有______.
(2)试样中碳酸钠的质量分数(结果精确到0.1%).
【答案】分析:(1)欲知A点产生气体的质量,须知反应物的质量和反应后的物质质量,因产生的气体全部逸出,所以A点产生气体的质量就是反应物的质量和反应后的物质质量之差;因为到A点时已完全反应,故B点时盐酸有剩余,故B点时,烧杯内溶液中的溶质是NaCl和HCl;
(2)欲求试样中碳酸钠的质量分数,须知碳酸钠的质量和总质量,由方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑和生成的二氧化碳的质量,可求出碳酸钠的质量,则根据碳酸钠的质量可求出试样中碳酸钠的质量分数.
解答:解:(1)由题意可知反应时产生的气体全部逸出,由图象可知A点时正好完全反应,故A点时产生气体的质量为反应物的总质量减去反应后各物质的总质量,因此A点产生气体的质量m=6g+36.5g-40.3g=2.2g.因为B点时盐酸有剩余,故B点时烧杯内溶液中的溶质是反应生成的NaCl原有的氯化钠和和过量的盐酸.
(2)解:设6g试样中Na2CO3质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 2.2g

x=5.3g
试样中Na2CO3的质量分数为:
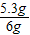 ×100%=88.3%
×100%=88.3%
故答案为:(1)2.2g;NaCl和HCl;(2)答:试样中Na2CO3的质量分数为88.3%
点评:本题主要检测学生对判定完全反应的方法的掌握,要求学生能正确判断完全反应,并根据已知条件计算质量分数;
(2)欲求试样中碳酸钠的质量分数,须知碳酸钠的质量和总质量,由方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑和生成的二氧化碳的质量,可求出碳酸钠的质量,则根据碳酸钠的质量可求出试样中碳酸钠的质量分数.
解答:解:(1)由题意可知反应时产生的气体全部逸出,由图象可知A点时正好完全反应,故A点时产生气体的质量为反应物的总质量减去反应后各物质的总质量,因此A点产生气体的质量m=6g+36.5g-40.3g=2.2g.因为B点时盐酸有剩余,故B点时烧杯内溶液中的溶质是反应生成的NaCl原有的氯化钠和和过量的盐酸.
(2)解:设6g试样中Na2CO3质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 2.2g

x=5.3g
试样中Na2CO3的质量分数为:
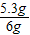 ×100%=88.3%
×100%=88.3%故答案为:(1)2.2g;NaCl和HCl;(2)答:试样中Na2CO3的质量分数为88.3%
点评:本题主要检测学生对判定完全反应的方法的掌握,要求学生能正确判断完全反应,并根据已知条件计算质量分数;

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案
相关题目
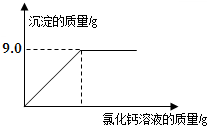 用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品10g溶解于水中,再滴加氯化钙溶液,产生沉淀的质量如图所示,求:该纯碱样品中碳酸钠的质量分数.
用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品10g溶解于水中,再滴加氯化钙溶液,产生沉淀的质量如图所示,求:该纯碱样品中碳酸钠的质量分数.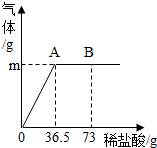 为测定某纯碱(Na2CO3)样品中(含有少量的氯化钠杂质)碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(产生的气体全部逸出).产生气体的质量与滴入稀盐酸的质量关系如图所示.
为测定某纯碱(Na2CO3)样品中(含有少量的氯化钠杂质)碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(产生的气体全部逸出).产生气体的质量与滴入稀盐酸的质量关系如图所示.
 为测定某纯碱样品中(含有少量的氯化钠杂质)碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(产生的气体全部逸出).产生气体的质量与滴入稀盐酸的质量关系如图所示,试计算:
为测定某纯碱样品中(含有少量的氯化钠杂质)碳酸钠的质量分数,现称取6g试样放在烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(产生的气体全部逸出).产生气体的质量与滴入稀盐酸的质量关系如图所示,试计算: