题目内容
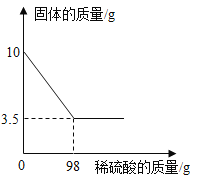
【题目】黄铜是铜和锌的合金。为了测定某黄铜中铜的质量分数,称取10.0g黄铜样品置于烧杯中,慢慢加入稀硫酸使其充分反应,直至固体质量不再减少为止,此时共用去98.0g稀硫酸,将反应后的剩余物过滤、干燥,称得剩余固体3.5g。试计算:
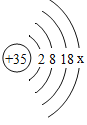
求:(1)铜样品中锌的质量是______(直接填结果);
(2)所用稀硫酸溶液的溶质质量分数是_____?(写过程)
【答案】6.5g 10%
【解析】
黄铜中的锌与稀硫酸反应生成氢气,铜不与稀硫酸反应,因此固体减少的质量是黄铜中的锌的质量。
(1)铜样品中锌的质量是:10.0g-3.5g=6.5g;
(2)设所用稀硫酸溶液中溶质的质量为x。
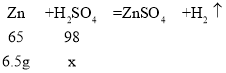
![]() ,解得x=9.8g
,解得x=9.8g
所用稀硫酸溶液的溶质质量分数为:![]() =10%
=10%

【题目】利用下表中的装置进行实验。有关该实验说法不正确的是( )
实验装置 | 实验步骤 |
| ①将a试管充满二氧化碳,b试管加入紫色石蕊溶液(K处于关闭状态) ②密闭下,用针筒将a试管中部分二氧化碳抽出 |
A. 用针筒将部分二氧化碳抽出,a试管中气体分子间间隔变大
B. 打开K,b试管中的液体颜色变红
C. 打开K,导管E内液面上升
D. 打开K,发生反应:H2O+CO2==H2CO3
【题目】某同学利用如图所示装置,选用不同可燃物测定空气里氧气的含量。实验起始时在集气瓶中装入少量水,并将水面上方空间分为五等份。将燃烧匙内的可燃物加热至燃烧或红热后,伸入瓶中塞紧瓶塞。冷却至室温后打开弹簧夹,记录数据如下表(装置的气密性良好)。
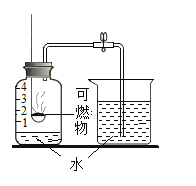
实验编号 | 可燃物 | 进入集气瓶中水的高度 |
① | 镁带 | 等于3格 |
② | 铁丝 | 几乎为0 |
③ | 红磷 | 约为0.6格 |
④ | 红磷 | 约为1.5格 |
下列有关解释不合理的是
A.实验①可能原因是:镁带除与氧气反应外,还能与空气中的其他气体反应
B.实验②可能原因是:铁丝燃烧消耗的氧气与生成的气体体积相等
C.实验③可能原因是:红磷量太少,集气瓶中的氧气未完全反应
D.实验④可能原因是:红磷点燃后,插入燃烧匙时,未迅速塞紧瓶塞,有部分空气逸出