题目内容
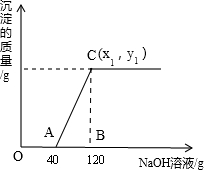
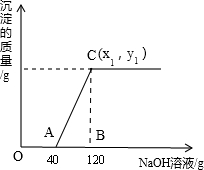
 有盐酸和MgCl2的混合溶液共100g,向混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成的沉淀与加入的NaOH溶液质量关系如图所示.若HCl在混合溶液中质量分数为3.65%.求:
有盐酸和MgCl2的混合溶液共100g,向混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成的沉淀与加入的NaOH溶液质量关系如图所示.若HCl在混合溶液中质量分数为3.65%.求:
(1)A点溶液的溶质化学式为______;
(2)与盐酸反应的氢氧化钠质量为______g.
(3)恰好沉淀完全时,C点所得溶液中溶质的质量分数是多少?(结果精确到0.1%,写出计算过程)
解:(1)由图示数据可知,开始加入氢氧化钠溶液至A时,没有沉淀生成,说明是氢氧化钠先与盐酸反应,而氯化镁尚未反应.此时溶液中的溶质为:NaCl和MgCl2;
(2)由题意知与氢氧化钠反应的HCl质量是100g×3.65%=3.65g
设与盐酸反应的氢氧化钠质量为x,生成氯化钠质量是y
NaOH+HCl=NaCl+H2O
40 36.5 58.5
x 3.65g y

x=4g y=5.85g
(3)与氯化镁反应的氢氧化钠溶液的质量为120g×10%-4g=8g
设反应中生成的氢氧化镁沉淀的质量为z,生成氯化钠的质量为w,
2NaOH+MgCl2=2NaCl+Mg(OH)2↓
80 117 58
8g z w
 ,
,
z=11.7g w=5.8g;
则反应至C点时溶液中溶质的质量分数为: ×100%=8.2%.
×100%=8.2%.
故答案为:(1)NaCl和MgCl2;(2)与盐酸反应的氢氧化钠质量为4g;(3)恰好完全沉淀时所得溶液中溶质的质量分数为8.2%;
分析:(1)依据A点的反应恰好是盐酸和氢氧化钠刚好完成的知识分析解答;
(2)依据HCl在混合溶液中质量分数为3.65%,利用盐酸与氢氧化钠反应的方程式分析解答;
(3)分析题意可知,反应至C点时溶液中溶质为氯化钠,分析题意可知,反应至C点时溶液中溶质为氯化钠,根据氢氧化钠、氯化镁与盐酸反应的化学方程式,列出比例式,计算出生成氯化钠的质量,然后计算即可;
点评:本题主要考查学生利用化学方程式和溶质质量分数公式进行计算的能力,学生要有较强的识图能力和数据分析能力,才能正确解答.
(2)由题意知与氢氧化钠反应的HCl质量是100g×3.65%=3.65g
设与盐酸反应的氢氧化钠质量为x,生成氯化钠质量是y
NaOH+HCl=NaCl+H2O
40 36.5 58.5
x 3.65g y

x=4g y=5.85g
(3)与氯化镁反应的氢氧化钠溶液的质量为120g×10%-4g=8g
设反应中生成的氢氧化镁沉淀的质量为z,生成氯化钠的质量为w,
2NaOH+MgCl2=2NaCl+Mg(OH)2↓
80 117 58
8g z w
 ,
,z=11.7g w=5.8g;
则反应至C点时溶液中溶质的质量分数为:
 ×100%=8.2%.
×100%=8.2%.故答案为:(1)NaCl和MgCl2;(2)与盐酸反应的氢氧化钠质量为4g;(3)恰好完全沉淀时所得溶液中溶质的质量分数为8.2%;
分析:(1)依据A点的反应恰好是盐酸和氢氧化钠刚好完成的知识分析解答;
(2)依据HCl在混合溶液中质量分数为3.65%,利用盐酸与氢氧化钠反应的方程式分析解答;
(3)分析题意可知,反应至C点时溶液中溶质为氯化钠,分析题意可知,反应至C点时溶液中溶质为氯化钠,根据氢氧化钠、氯化镁与盐酸反应的化学方程式,列出比例式,计算出生成氯化钠的质量,然后计算即可;
点评:本题主要考查学生利用化学方程式和溶质质量分数公式进行计算的能力,学生要有较强的识图能力和数据分析能力,才能正确解答.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
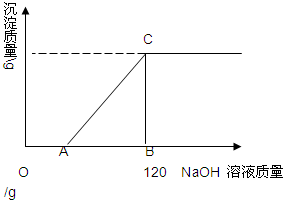
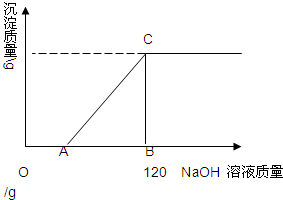 有盐酸和MgCl2的混合溶液共100g,向混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成的沉淀与加入的NaOH溶液质量关系如图所示.若HCl在混合溶液中质量分数为3.65%.求:
有盐酸和MgCl2的混合溶液共100g,向混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成的沉淀与加入的NaOH溶液质量关系如图所示.若HCl在混合溶液中质量分数为3.65%.求: