题目内容
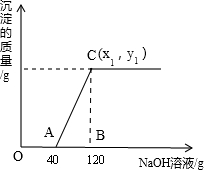
有盐酸和MgCl2的混合溶液100g,向混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成的沉淀与加入的10%的NaOH溶液质量关系如图所示.若MgCl2在混合溶液中质量分数为9.5%.求:
(1)A点处溶液中的溶质化学式为______.
(2)恰好沉淀完全时,所得溶液中溶质的质量分数是多少?(结果精确到0.1%)______
(3)C点的坐标(x1,y1)中为______.
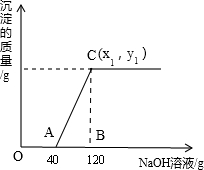
(1)A点处溶液中的溶质化学式为______.
(2)恰好沉淀完全时,所得溶液中溶质的质量分数是多少?(结果精确到0.1%)______
(3)C点的坐标(x1,y1)中为______.

(1)由图示数据可知,开始加入氢氧化钠溶液至40g时,没有沉淀生成,说明是氢氧化钠先与盐酸反应,而氯化镁尚未反应.故答案为:NaCl和MgCl2;
(2)设反应中生成的氢氧化镁沉淀的质量为x,生成氯化钠的质量为y,消耗的氢氧化钠溶液的质量为a
2NaOH+MgCl2=2NaCl+Mg(OH)2↓
80 95 117 58
10%a 100g×9.5% y x
∴
=
=
=
,
∴a=80g;x=5.8g;y=11.7g;
(3)设生成氯化钠的质量为z,
NaOH+HCl=NaCl+H2O
40 58.5
40g×10%,z
∴
=
∴z=
=5.85g;
则反应至C点时溶液中溶质的质量分数为:
×100%=8.2%.
答:(2)恰好完全沉淀时所得溶液中溶质的质量分数为8.2%;
(3)(5.8,120)
(2)设反应中生成的氢氧化镁沉淀的质量为x,生成氯化钠的质量为y,消耗的氢氧化钠溶液的质量为a
2NaOH+MgCl2=2NaCl+Mg(OH)2↓
80 95 117 58
10%a 100g×9.5% y x
∴
| 80 |
| 10%a |
| 95 |
| 100g×9.5% |
| 117 |
| y |
| 58 |
| x |
∴a=80g;x=5.8g;y=11.7g;
(3)设生成氯化钠的质量为z,
NaOH+HCl=NaCl+H2O
40 58.5
40g×10%,z
∴
| 40 |
| 58.5 |
| 40g×10% |
| z |
∴z=
| 40g×10%×58.5 |
| 40 |
则反应至C点时溶液中溶质的质量分数为:
| 11.7g+5.85g |
| 100g+120g-5.8g |
答:(2)恰好完全沉淀时所得溶液中溶质的质量分数为8.2%;
(3)(5.8,120)

练习册系列答案
相关题目
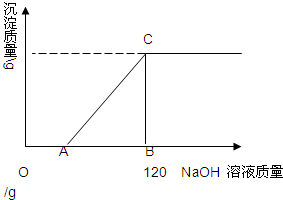 有盐酸和MgCl2的混合溶液共100g,向混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成的沉淀与加入的NaOH溶液质量关系如图所示.若HCl在混合溶液中质量分数为3.65%.求:
有盐酸和MgCl2的混合溶液共100g,向混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成的沉淀与加入的NaOH溶液质量关系如图所示.若HCl在混合溶液中质量分数为3.65%.求:
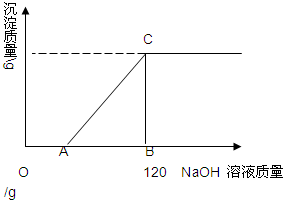 有盐酸和MgCl2的混合溶液共100g,向混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成的沉淀与加入的NaOH溶液质量关系如图所示.若HCl在混合溶液中质量分数为3.65%.求:
有盐酸和MgCl2的混合溶液共100g,向混合溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成的沉淀与加入的NaOH溶液质量关系如图所示.若HCl在混合溶液中质量分数为3.65%.求: