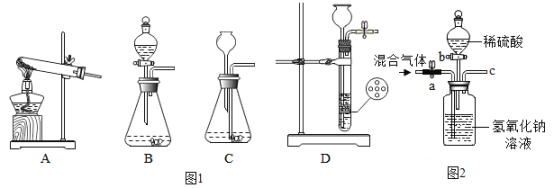
题目内容
【题目】现有硫酸钠和氯化钠的固体混合物30g,加316.6g水使之全部溶解,将300g氯化钡溶液分三次加入该溶液中,实验数据记录如下表:
第1次 | 第2次 | 第3次 | |
加入氯化钡溶液质量/g | 100 | 100 | 100 |
生成沉淀的质量/g | 23.3 | m | 46.6 |
(1)表中m的数值是_______。
(2)原固体混合物中硫酸钠的质量分数是多少_______?(计算结果精确到0.1%)
(3)恰好完全反应时,所得溶液中溶质的质量分数的多少______?
【答案】46.693.3%5.08%
【解析】
(1)根据表中数据可知,第一次加入100g氯化钡溶液生成23.3g沉淀,说明每100g氯化钡溶液完全反应时对应的沉淀质量为23.3g,第三次加入100g氯化钡溶液沉淀质量为46.6g,故第二次又生成23.3g沉淀,且硫酸根离子已经被完全消耗,第三次无沉淀生成,故m=46.6。
(2)由(1)可知,硫酸钠和氯化钡溶液反应共生成硫酸钡沉淀46.6g,假设原固体混合物中硫酸钠的质量为x。
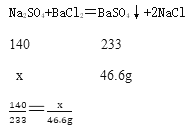
解得x=28g,原固体混合物质量为30g,故硫酸钠的质量分数=![]() ×100%≈93.3%
×100%≈93.3%
(3)恰好完全反应时,所得溶液中溶质为氯化钠,假设反应生成氯化钠质量为y。
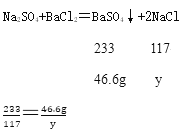
解得y=23.4g,原混合物中氯化钠质量=30g-28g=2g,故氯化钠总质量为25.4g。恰好完全反应时,加入氯化钡质量为200g,故反应后溶液质量=30g+316.6g+200g-46.6g=500g。所得溶液中溶质的质量分数=![]() ×100%=5.08%。
×100%=5.08%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
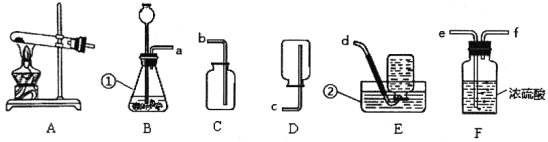
小学生10分钟应用题系列答案【题目】在测定空气中氧气含量的实验中,小强采用了如图所示装置:在由两个注射器组成的密闭系统中留有25 mL空气,给装有细铜丝的玻璃管加热,同时交替缓慢推动两个注射器活塞,至玻璃管内的铜丝在较长时间内无进一步变化时停止加热,待冷却至室温,将气体全部推至一个注射器内,观察密闭系统内空气体积变化。
 (第14题)
(第14题)
反应前注射器内气体总体积 | 反应后注射器内气体总体积 |
25 mL | 22 mL |
(1)在实验加热过程中,交替缓慢推动两个注射器活塞的目的是______________。
(2)写出该实验中反应的文字表达式____________。
(3)小强测得结果如上表:由此数据可以推算出他测定的空气中氧气的体积分数________21%(填“>”“=”或“<”)。造成该实验出现误差的原因可能是____________。(填序号)
①没有交替缓慢推动两个注射器活塞
②读数时没有冷却至室温
③加入铜丝量太少
④加入铜丝量太多
(4)通过上面的实验,你学到的测量混合物中某成分含量的方法是______________。
(5)实验中的一些原因或者装置本身可能导致实验失败,请列举一条: ______________。