题目内容
(1)如图是实验室制取二氧化碳并验证其性质的装置图,回答:
①A是实验室制取二氧化碳的装置,内装药品为 ;
②B的试管中装有滴有紫色石蕊的蒸馏水,现象为 ;
③装置C中有澄清石灰水,其中发生化学反应的化学方程式为 ;
④装置D中有两支高低不同的燃着的蜡烛,可观察低处的蜡烛先灭,高处的蜡烛后灭,说明二氧化碳
具有 性质。
(2)实验室有一瓶化肥的标签已脱落,只知道它是NH4Cl、(NH4)2SO4、NH4HCO3和尿素[CO(NH2)
2]中的一种,请你完成以下探究:
[猜想]猜想A:该化肥是NH4Cl,猜想B:该化肥是(NH4)2SO4,猜想C:该化肥是NH4HCO3,猜
想D:该化肥是尿素。
[实验探究]
(Ⅰ)取少量样品在研钵中与熟石灰研磨,有刺激性气味的气体放出,证明猜想 不成立。
(Ⅱ)如图(甲),分别取少量样品于试管中,滴加适量水振荡,再选(乙)中 溶液滴入试管
中,若无气泡放出,则猜想 不成立。
(Ⅲ)在步骤(Ⅱ)的试管中再滴入(乙)中的 溶液,若 ,则猜想A成立;若 ,则猜想B成立,其反应的化学方程式为: (注:乙图中药品为食盐、氯化钡、盐酸三种溶液)。
①大理石、稀盐酸 ②紫色石蕊试液变红 ③CO2+Ca(OH)2=CaCO3↓+H2O;④密度比空气大,一般不能燃烧也不能支持燃烧 (Ⅰ)D;(Ⅱ) HCl;C;(Ⅲ) BaCl2;无白色沉淀;有白色沉淀; BaCl2+(NH4)2SO4=BaSO4↓+2NH4Cl
解析试题分析:(1)实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热。二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;二氧化碳的化学性质有:既不能燃烧也不能支持燃烧,也不供给呼吸;能与水反应生成碳酸,碳酸能使紫色石蕊试液变红色;能使澄清的石灰水变浑浊,是因为二氧化碳与氢氧化钙反应生成碳酸钙白色沉淀和水;故答案为:①大理石、稀盐酸 ②紫色石蕊试液变红 ③CO2+Ca(OH)2=CaCO3↓+H2O;④密度比空气大,一般不能燃烧也不能支持燃烧。
(2)铵根离子一般用碱来检验,铵态氮肥遇到碱性物质会放出氨气,而尿素不是铵态氮肥,因此不会放出氨气;分别取少量样品于试管中,滴加适量水振荡,再选稀盐酸滴入,若无气泡放出,则不是碳酸氢铵;在步骤(Ⅱ)的试管中再滴入(乙)中的氯化钡溶液,若无白色沉淀,该化肥是NH4Cl;若有白色沉淀,该化肥是(NH4)2SO4;氯化钡和硫酸铵反应生成硫酸钡白色沉淀和氯化铵,配平即可;故答案为:(Ⅰ)D;(Ⅱ) HCl;C;(Ⅲ) BaCl2;无白色沉淀;有白色沉淀; BaCl2+(NH4)2SO4=BaSO4↓+2NH4Cl。
考点:考查二氧化碳的实验室制法;二氧化碳的化学性质;化肥的简易鉴别;铵态氮肥的检验

 同步练习强化拓展系列答案
同步练习强化拓展系列答案某化学兴趣小组对一包干燥的红色粉末组成进行探究。请你参与并回答问题。
【教师提醒】它由Cu 、Fe2O3两种固体中的一种或两种组成。
【提出猜想】红色粉末可能的组成,
猜想①:只有Cu;猜想②:只有 ;猜想③:是Cu 、Fe2O3的混合物
【实验探究】
同学们为确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按右下图在通风橱中进行实验。开始时缓缓通入CO气体,过一段时间后再加热使其充分反应。待反应完全后,停止加热,继续通CO气体直至玻璃管冷却。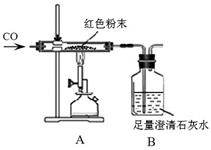
(1)在装置A中先通CO气体的目的是 。A装置中发生反应的化学方程式 ;实验中观察到A装置中的现象为 。
(2)反应前后称量相关装置和物质的总质量,其数据如下表:
| 反应前 | 反应后 |
| 玻璃管和红色粉末的总质量为37.3 g | 玻璃管和固体物质的总质量为36.1 g |
小蒋同学初步分析表中的数据后,马上得出猜想 (填“①”“②”“③”)肯定不正确,理由是 。
(3)小林同学认为为了防止溶液倒吸,本实验停止加热前应 先断开A和B的连接,你认为是否需要? (填“需要”或“不需要”),理由是 。
【反思评价】实验后小组内有同学指出:上图装置未进行尾气的处理。于是有同学设计了用右图装置代替原装置,则C装置的作用有 、 (至少答两点)。

某食品保鲜剂(生石灰或铁粉的一种)在空气中放置一段时间后,小王同学对原保鲜剂成分进行探究,设计了如下实验方案:
取少量样品于试管中,加入少量的稀盐酸,有无色无味的气体产生,他断定原保鲜剂是铁粉.该同学的实验方案是否合理?并说明理由.
请你设计一个用化学方法确定保鲜剂成分的实验方案,填入下表:
| 操作 | 主要现象 | 原保鲜剂的成分 | 有关的化学方程式 |
| | | | |
某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图所示液,他们对此产生了兴趣。
[提出问题]这瓶溶液究竟是什么?
经过询问实验老师平时的药品保管得知,这瓶无色溶液应该是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中的某一种。为了确定该药品,他们首先进行了理论分析:
(1)小明根据标签上的组成元素认为一定不可能是 。
(2)小英提出,碳酸氢钠、硝酸钠也不可能,你认为她的依据是 。
为了确定该溶液究竟是剩余两种盐的哪一种,他们设计了如下实验。
[设计实验]
| 实验操作 | 实验现象 |
| 取少量样品于试管中,慢慢滴加BaCl2溶液,静置一段时间,倾去上层清液,向沉淀中继续滴加稀盐酸 | 先出现白色沉淀,后产生大量气泡 |
[实验结论]该瓶无色溶液是 。
生成白色沉淀过程的化学方程式是 。
[实验反思]小强认为上述设计实验还可简化,仍能达到目的。小强的实验操作是 。经查阅资料得知上述五种盐里碳酸钠、碳酸氢钠的溶液呈碱性,其余三种盐的溶液呈中性,请你再设计一种实验方法,确定该溶液究竟是哪种盐,简述实验操作和现象 。
某化学活动小组开展了一次关于金属镉与铜、银活动性顺序的探究.
[提出问题]这三种金属活动性顺序是怎样的?
[猜想假设]猜想①:Cu>Cr>Ag 猜想②:Cu>Ag>Cr 猜想③:
[查阅资料]
①镉(Cr)是一种银白色金属,在化合价中通常表现为+2价.
②水体中镉元素通常以氯化镉的形式存在.
③氯化镉、硝酸镉都能溶于水,氢氧化镉难溶于水.
[实验探究]
| 实验步骤 | 实验现象 | 实验结论 | 化学方程式 |
| 取适量镉、铜、银与试管中,加入适量 稀盐酸(或稀硫酸) | 镉表面有气泡产生,铜银表面无气泡产生 | | 写出镉和稀盐酸反应的化学方程式 |
| 取适量铜片与试管中,加入少量的硝酸银溶液 | , | 铜的活动性顺序大于银 | 铜与硝酸银反应的化学方程式 |
[实验结论]活动性由强到弱的顺序:
[反思]实验中需对金属片用砂纸打磨,其目的是 .
在学习碳酸钠的性质的课堂上,老师在碳酸钠溶液中加入一定量的澄清石灰水产生白色沉淀,在滤出沉淀后的滤液,引导同学们对滤液中溶质的成分进行探究.同学们通过讨论认为溶质是NaOH、Na2CO3、Ca(OH)2中的一种或两种,其可能情况有三种:①NaOH;②NaOH和Na2CO3;③ 。
小伟同学设计了下列实验方案,请你帮助完成.
| 实 验 步 骤 | 可能出现的实验现象 | 实验结论 |
| (1)取少量滤液于试管中,加入碳酸钠溶液 | 产生 | 假设③成立 |
| (2)取少量滤液于试管中,加入足量稀盐酸 | 放出无色气体 | 假设 成立 |
| (3)取少量滤液于试管中,加入碳酸钠溶液或足量稀盐酸 | 没有明显现象 | 假设 成立 |
某兴趣小组同学对实验室制备氧气的条件进行如下探究实验。
①为探究催化剂的种类对氯酸钾分解速度的影响,甲设计以下对比实验:
Ⅰ.将3.0g KClO3与1.0g MnO2均匀混合加热
Ⅱ.将x g KClO3与1.0g CuO均匀混合加热在相同温度下,比较两组实验产生O2的快慢。
Ⅱ中x的值应为________。
②乙探究了影响双氧水分解速度的某种因素。实验数据记录如下:
| | 双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2体积 |
| Ⅰ | 50.0g | 1% | 0.1g | 9 mL |
| Ⅱ | 50.0g | 2% | 0.1g | 16 mL |
| Ⅲ | 50.0g | 4% | 0.1g | 31 mL |
本实验中,测量O2体积的装置是________(填编号)。

实验结论:在相同条件下,_______________,双氧水分解得越快。
丙用下图装置进行实验,通过比较____________也能达到实验目的。


