题目内容
16.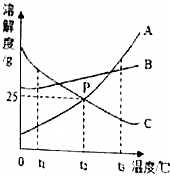 A、B、C三种固体物质溶解度曲线如图所示,请回答:
A、B、C三种固体物质溶解度曲线如图所示,请回答:(1)图中P点的意义t2℃时A和C的溶解度相等.
(2)要除去A中混有少量的B,可采用降温结晶的方法.
(3)现有t1℃时A、B、C的三种饱和溶液,分别将它们升温到t3℃,所得溶液中溶质的质量分数由大到小的顺序是B>C>A.
(4)在t2℃时,有100gA的饱和溶液,加100g水可稀释为溶质质量分数为10%的A溶液.
分析 (1)根据交点表示在该温度下二者的溶解度相等解答;
(2)根据固体物质从溶液中结晶析出的方法考虑;
(3)根据升高温度溶质质量分数的变化考虑;
(4)根据稀释前后溶质质量不变解答.
解答 解:(1)P点表示在t2℃时A和C的溶解度相等,故填:.
(2)据图可以看出,A物质的溶解度受温度影响变化大,故要除去A中混有少量的B,可采用降温结晶的方法,故填:降温结晶.
(3)现有t1℃时A、B、C的三种饱和溶液,分别将它们升温到t3℃,AB的溶解度随温度升高而增大,故溶液的组成不变,溶质质量分数与t1℃时相同,C的溶解度减小,但是t3℃时,C的溶解度大于t1℃时的A的溶解度,故所得溶液中溶质的质量分数由大到小的顺序是B>C>A,故填:B>C>A.
(4)在t2℃时,有100gA的饱和溶液中含有溶质质量为:$\frac{25g}{125g}×100g$=20g,设加水的质量为x,则有:$\frac{20g}{100g+x}×100%=10%$,x=100g,故填:100.
点评 本题考查溶解度曲线的意义及应用,根据溶解度曲线可判断饱和溶液与不饱和溶液转化的方法,对于溶解度随温度升高而增大的物质,由不饱和溶液变成饱和溶液只能是降温,本考点主要出现在选择题和填空题中.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.某同学对一瓶长期暴漏在空气中的氢氧化钠固体样品的成分及含量进行探究.
【提出问题】该样品中含有哪些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3.
则NaOH变质反应的化学方程式为CO2+2NaOH=Na2CO3+H2O;
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
②CO2在饱和碳酸氢钠溶液汇总几乎不溶解.
【实验探究】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告.
【提出问题2】怎样提纯该样品得到纯净的氢氧化钠固体?
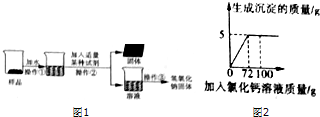
【实验探究2】为得到纯净的氢氧化钠固体,小亮明设计了如图1所示的实验流程.请回答下列问题:
(1)该实验中发生反应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(2)最终所得氢氧化钠固体质量大于(填“大于”、“等于”或“小于”)变质后样品中氢氧化钠的质量.
【实验反思】
(1)通过本题,你学会了定性检验氢氧化钠的变质和除杂提纯物质.为了得到可靠的实验结果,探究过程中你需要思考的问题有①②④⑤⑥(填数字序号);
①选择试剂种类 ②确定试剂用量 ③试剂产地 ④实验装置与步骤的设计 ⑤实验安全环保 ⑥测量中减少误差.
(2)向50g Na2co3溶液总逐滴加入一定溶质质量分数的CaCl2溶液,实验过程中,生成沉淀的质量与加入CaCl2溶液的质量关系如图所示,试计算:恰好完全反应时,所得溶液中溶质的质量分数.
【提出问题】该样品中含有哪些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3.
则NaOH变质反应的化学方程式为CO2+2NaOH=Na2CO3+H2O;
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
②CO2在饱和碳酸氢钠溶液汇总几乎不溶解.
【实验探究】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告.
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量样品溶于水,加入 过量CaCl2溶液; | 白色沉淀产生 | 该反应的化学方程式:Na2CO3+CaCl2═2NaCl+CaCO3↓ |
| (2)将上述反应后的混合液过滤,取滤液加入酚酞试液; | 溶液变红色 | 证明猜想Ⅱ正确 |
【实验探究2】为得到纯净的氢氧化钠固体,小亮明设计了如图1所示的实验流程.请回答下列问题:
(1)该实验中发生反应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(2)最终所得氢氧化钠固体质量大于(填“大于”、“等于”或“小于”)变质后样品中氢氧化钠的质量.
【实验反思】
(1)通过本题,你学会了定性检验氢氧化钠的变质和除杂提纯物质.为了得到可靠的实验结果,探究过程中你需要思考的问题有①②④⑤⑥(填数字序号);
①选择试剂种类 ②确定试剂用量 ③试剂产地 ④实验装置与步骤的设计 ⑤实验安全环保 ⑥测量中减少误差.
(2)向50g Na2co3溶液总逐滴加入一定溶质质量分数的CaCl2溶液,实验过程中,生成沉淀的质量与加入CaCl2溶液的质量关系如图所示,试计算:恰好完全反应时,所得溶液中溶质的质量分数.

4.下列实验操作中正确的是( )
| A. |  取锌粒 | B. | 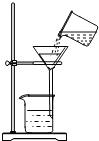 过滤 | C. | 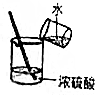 稀释浓硫酸 | D. |  点燃酒精灯 |
11.下列物质能在溶液中大量共存且溶液为无色的是( )
| A. | FeCl3、H2SO4 | B. | MgSO4、Ca(OH)2 | C. | NaOH、NaCl | D. | Ca(OH)2、Na2CO3 |
5.天津港爆炸救援时,防化团官兵伸入爆炸核心区时应携带的物质是( )
| A. | 氧气 | B. | 臭氧 | C. | 二氧化碳 | D. | 氮气 |
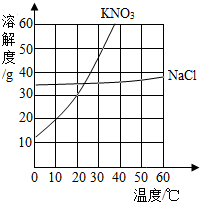 根据如图所示的溶解度曲线,回答下列问题.(1)10℃时,100g水中加入20gKNO3达到饱和状态;
根据如图所示的溶解度曲线,回答下列问题.(1)10℃时,100g水中加入20gKNO3达到饱和状态; 哈尔滨漫长而寒冷的冬季,人们常常使用填充棉花的棉衣来保暖.
哈尔滨漫长而寒冷的冬季,人们常常使用填充棉花的棉衣来保暖.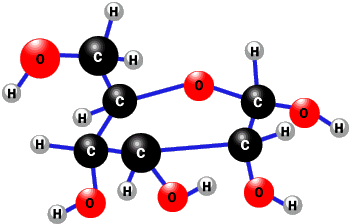 葡萄糖是生活中最常见的一种糖类,其结构如图,下列说法正确的是( )
葡萄糖是生活中最常见的一种糖类,其结构如图,下列说法正确的是( )