题目内容
【题目】化学教师在通风橱里表演了小魔术“无中生有”:如图1所示,相同条件下,A、B两个体积相同的集气瓶中分别充满无色的硫化氢(H2S)气体和二氧化硫气体.抽开毛玻璃片,瓶口对紧,颠倒几次,使两种气体充分混合。一会儿,观察到两瓶内壁附着淡黄色固体颗粒。请回答下列问题:
(1)若用“●”表示氢原子,用“○”表示氧原子,用“![]() ”表示硫原子,上述反应过程可用如图2表示:
”表示硫原子,上述反应过程可用如图2表示:
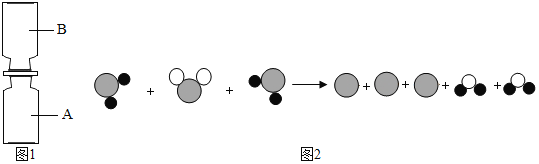
该反应的化学方程式为_____;
(2)若这两个瓶子是质地较软的塑料瓶,我们将会观察到塑料瓶变瘪了,原因是_____。
(3)已知:相同条件下,相等体积的气体所含的分子数目相等。反应完毕,瓶中剩余的气体为_____,处理该气体的方法(用化学方程式表示)是_____。;
(4)某同学对H2S气体很感兴趣,通过查资料得知:H2S气体有臭鸡蛋气味,水溶液是一种酸。他将H2S气体通入硫酸铜溶液中,发现有黑色沉淀生成,同时溶液的酸性增强。试写出有关反应方程式_____。
【答案】2H2S+SO2=3S↓+2H2O H2S与SO2反应后生成固态的硫和液态的水,使瓶内的压强小于瓶外的大气压 SO2 SO2+2NaOH=Na2SO3+H2O H2S+CuSO4=CuS↓+H2SO4
【解析】
(1)根据反应的微观图示,每2个H2S分子可与1个SO2分子反应,生成三个硫原子和两个水分子,据此可写出化学方程式:2H2S+SO2=3S+2H2O.故填:2H2S+SO2=3S↓+2H2O;
(2)硫化氢和二氧化硫反应生成硫和水,瓶内压强减小,在外界大气压的作用下瓶子瘪了,故填:H2S与SO2反应后生成固态的硫和液态的水,使瓶内的压强小于瓶外的大气压;
(3)已知相同条件下,相等体积的气体所含的分子数目相等,而反应时硫化氢和二氧化硫的分子个数比是2:1,故剩余的气体的二氧化硫气体;由于二氧化硫能与氢氧化钠反应,所以,处理的方法是倒入少量氢氧化钠溶液,振荡,反应的方程式是:SO2+2NaOH═Na2SO3+H2O;故填:SO2;SO2+2NaOH=Na2SO3+H2O;
(4)由题意可知,H2S气体通入硫酸铜溶液中,生成了硫化铜沉淀和硫酸.反应的方程式是:H2S+CuSO4=CuS↓+H2SO4。故填:H2S+CuSO4=CuS↓+H2SO4。