题目内容
【题目】已知氯化钠和氯化钙的混合物中,钙元素的质量分数为20%.现取一定质量的该混合物放入烧杯中,与100g溶质质量分数为10.6%的碳酸钠溶液恰好完全反应。求:
(1)原混合物中氯化钠的质量为多少克_____。
(2)反应后所得溶液的溶质质量分数_____。
【答案】8.9克 18.7%
【解析】
解:参加反应的碳酸钠的质量100g×10.6%=10.6g
设氯化钙的质量为x,生成的氯化钠的质量为y,生成的碳酸钙的质量为z
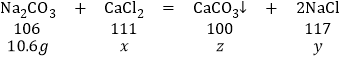
106:111=10.6g:x x=11.1g
106:117=10.6g:y y=11.7g
106:100=10.6g:z z=10g
氯化钙中钙元素的质量为11.1g×![]() ×100%=4g
×100%=4g
则氯化钠和氯化钙的混合物的质量为![]() =20g
=20g
氯化钠和氯化钙的混合物中氯化钠的质量为20g﹣11.1g=8.9g
反应后所得溶液的溶质质量分数为![]() ×100%≈18.7%
×100%≈18.7%
答:(1)原混合物中氯化钠的质量为8.9克。
(2)反应后所得溶液的溶质质量分数18.7%。

【题目】某化学兴趣小组的同学在实验室发现一瓶敞口放置的过氧化钠(Na2O2)固体,他们对该固体是否变质产生了兴趣,对固体成分进行了实验探究。
(查阅资料)
①在标准状况下,氧气的密度是1.429g/L.在室温下,1L水中能溶解约30mL的氧气。
②过氧化钠能与二氧化碳反应:2Na2O2+2CO2═2Na2CO3+O2↑
③过氧化钠能与水反应:2Na2O2+2H2O═4NaOH+O2↑
④BaCl2溶液呈中性。
(成分猜想)固体中可能有Na2O2、NaOH和Na2CO3中的一种或几种。
(实验验证)
实验步骤 | 实验现象 | 结论或化学方程式 |
(1)取少量样品于试管中,加水溶解,并立即将带火星的木条伸入试管中。 | 有气泡产生,_______ | 证明固体中含有Na2O2 |
取步骤(1)所得溶液于试管中,滴加过量的BaCl2溶液 | 有白色沉淀生成 | 证明固体中含有Na2CO3,化学方程式为_______ |
取步骤(2)中的上层清液于试管中,滴入1~2滴酚酞试液 | 溶液变红 | 证明固体中含有NaOH. |
(分析交流)经过讨论分析,同学们认为步骤(3)中的结论不合理,不能证明固体中含有NaOH,理由是_______。
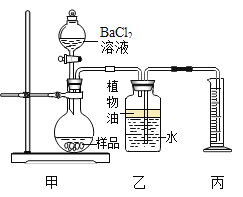
(继续探究)为确定固体中是否含有NaOH,取一定质量的样品,利用如图装置进行实验验证。(BaCl2溶液的体积和温度变化对气体体积的影响忽略不计)
(1)装置乙中植物油的作用是_______。
(2)待反应完全后,根据收集所得气体的体积,进行相关计算,得出样品中_______的质量。
(3)再将烧瓶中的沉淀进行过滤、洗涤、烘干、称量,进行相关计算,得出样品中_______的质量。
(实验结论)经过实验数据分析,得出固体中不但含有Na2O2和Na2CO3,还含有NaOH.证明含有NaOH的依据是_______。
【题目】小明同学对所学部分化学知识归纳如下。其中不正确的是( )
A | 须辨清的物质 | B | 初中化学中常见的“三” |
干冰不是冰﹣而是固体CO2 纯碱不是碱﹣而是盐 | 三种常见还原剂CO、H2、C 三种基本粒子﹣﹣原子、分子、离子 | ||
C | 化学巨匠及其杰出贡献 | D | 符号中数字“2”的意义 |
张青莲﹣测量相对原子质量 侯德榜﹣﹣发明联合制碱法 |
2O:两个氧原子 |
A. AB. BC. CD. D