题目内容
【题目】A~G是初中常见的7种物质,它们有如图所示的转化关系。已知A,C是无色液体,B, F, G是无色气体,其中大量排放F会引起温室效应,D是黑色固体,E在纯净的B中燃烧发出明亮的蓝紫色火焰。
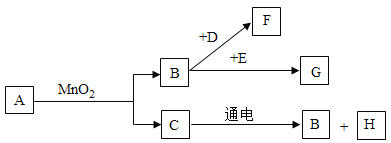
(1)请写出下列物质的化学式:D_________,G_______。
(2)请写出下列变化的化学符号表达式:
①C→B+H:____________,属_________反应(填反应的基本类型)
②实验室常用____________(填物质名称)检验F气体的存在,该反应的符号表达式为:__________
【答案】![]()
![]()
![]() 分解 澄清石灰水
分解 澄清石灰水 ![]()
【解析】
A、C是无色液体,B、F、G是无色气体,A与二氧化锰混合生成B和C,则A是过氧化氢,B是氧气,C是水,H是氢气;大量排放F会引起温室效应,则F是二氧化碳,E在纯净的B(氧气)中燃烧发出明亮的蓝紫色火焰,则E是硫,G是二氧化硫;D是黑色固体,与B(氧气)反应生成F(二氧化碳),则D是碳;代入验证即可。
A、C是无色液体,B、F、G是无色气体,A与二氧化锰混合生成B和C,则A是过氧化氢,B是氧气,C是水,H是氢气;大量排放F会引起温室效应,则F是二氧化碳,E在纯净的B(氧气)中燃烧发出明亮的蓝紫色火焰,则E是硫,G是二氧化硫;D是黑色固体,与B(氧气)反应生成F(二氧化碳),则D是碳;
(1)物质D、G的化学式分别为:![]() 、
、![]() 。
。
(2)①C→B+H为水在通电条件下反应生成氧气和氢气,反应的化学符号表达式为:![]() ,符合“一变多”特征,属于分解反应。
,符合“一变多”特征,属于分解反应。
②实验室检验F(二氧化碳)气体的存在,通常用澄清石灰水,氢氧化钙与二氧化碳反应生成碳酸钙白色沉淀和水,该反应的符号表达式为:![]() 。
。

【题目】学习化学离不开实验探究。请利用学过的化学知识完成下列实验探究。
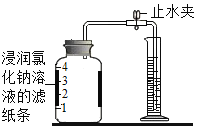
(一)某同学根据铁生锈的原理,用铁粉测定空气中氧气的含量,设计了如图实验,充分反应后测得数据如表:
实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 量筒内水 | 量筒内剩余水 |
250mL | 180.0mL | 129.5mL |
实验时该同学不是将铁粉堆在瓶底,而是将铁粉撒在浸润了氯化钠溶液的滤纸条上,再把该滤纸条贴在广口瓶内侧,其目的是________________,氯化钠溶液的作用是_________________。根据表中数据计算得出空气中氧气的体积分数为_____________(结果保留到0.1%)。与用红磷燃烧的方法相比,用该方法测定空气中氧气含量的主要优点:一是没有污染,二是_________________。
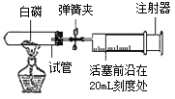
(二)为了探究二氧化碳的性质,某同学设计了如下图所示的实验:
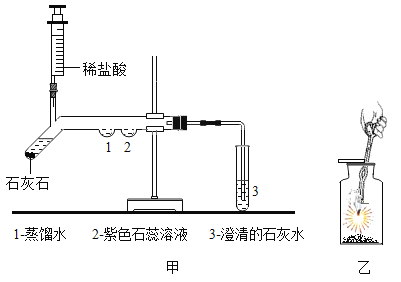
(1)用注射器注入稀盐酸,一段时间后,可观察到在1、2两处中有一处有明显的现象发生,发生该实验现象的符号表达式为__________________;该反应属于__________反应(填化合或分解)
(2)3处的澄清石灰水变浑浊,该反应的符号表达式为_________________;
(3)如图乙,将点燃的镁条伸入二氧化碳中,观察到镁条继续燃烧,请你写出一个对燃烧的新认识___________________.
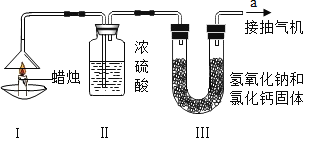
(三)为了测定蜡烛中碳、氢两种元素的质量比,某化学兴趣小组设计了如图所示的实验,实验步骤如下:先分别称量蜡烛、装置Ⅱ、装置Ⅲ的质量.(注:浓硫酸只吸收水分,氢氧化钠和氧化钙可吸收水也可吸收二氧化碳)按图示连接好仪器.点燃蜡烛,同时从a导管口抽气,一段时间后熄灭蜡烛,再分别称量蜡烛、装置Ⅱ、装置Ⅲ的质量,实验数据如表.
蜡烛 | 装置Ⅱ | 装置Ⅲ | |
反应前的质量/g | 15.8 | 182.3 | 212.2 |
反应后的质量/g | 14.4 | 184.1 | 216.6 |
(1)该实验中测得水的质量为___________g,二氧化碳的质量为___________g.
(2)由该实验数据计算,蜡烛中碳、氢元素的质量之比为___________.
(3)装置Ⅱ和装置Ⅱ的顺序能否颠倒:___________(填“能”或“不能”)
(4)理论上,装置Ⅱ和装置Ⅲ增加的总质量大于蜡烛失去的质量,其原因是___________.
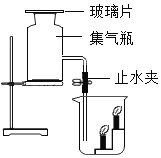
【题目】空气中氧气含量测定的再认识:
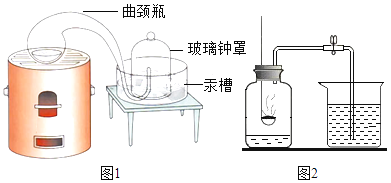
(1)[经典赏析]拉瓦锡用定量的方法研究空气的成分(实验装置如图1)。该实验中选择使用汞的优点有_____
A 汞俗称水银,常温下呈液态,安全无毒 B 能将密闭装置内空气中的氧气几乎耗尽
C 反应生成的氧化汞是固态,不影响压强 D 生成的化合物加热分解又能得到汞和氧气
(2)(实验回顾)实验室常用红磷燃烧的方法测定空气中氧气的含量(装置如图2),写出红磷燃烧的符号表达式_______。图2中集气瓶底部的水的作用为_____。(填一点即可)但是用该方法测出的氧气含量常常低于21%。
(3)(提出问题)用该方法测出的氧气含量为什么低于21%?
(进行猜想)①装置漏气;②_____,装置内氧气有剩余;

(4)(实验与交流)为了帮助同学们更好地理解空气中氧气含量测定的实验原理,老师利用传感器技术定时测定了实验装置(如图5)内的压强、温度和氧气浓度,三条曲线变化趋势如图6所示。X曲线表示压强变化趋势,Y曲线表示_____(填“温度”或“氧气浓度”)变化趋势。

(5)(实验探究1)已知,铁丝在纯氧中才能燃烧,反应的符号表达式为_____,一般不能在空气中燃烧,因此无法用铁丝代替红磷进行该实验。小明根据铁生锈的原理(铁在常温下可以和氧气、水生成铁锈)来测定空气中氧气的含量,于是进行了实验(装置如图3)。通过7天测得的数据计算出空气中氧气的含量为19.13%。
(交流与反思)与用红磷燃烧的方法相比,用铁丝生锈的方法的主要优点_____(填字母)。
A 装置内残留的氧气更少 B 铁丝生锈比红磷燃烧反应更快 C 反应更彻底,实验结果更准确
(6)(实验探究2)小明利用铁粉、炭粉、氯化钠等物质又进行了实验(装置如图4)。8分钟后测得的数据如下表:请计算出空气中氧气含量______(计算结果保留一位小数)。
实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 烧杯内蒸馏水 | 烧杯内剩余蒸馏水 |
131mL | 90.0mL | 63.4mL |
(7)(拓展延伸)铜能与空气中氧气、水、二氧化碳反应生成铜绿(其主要成分为:Cu2(OH)2CO3).写出生成铜绿的符号表达式_____。
(8)请计算:Cu2(OH)2CO3的相对分子质量是_____。