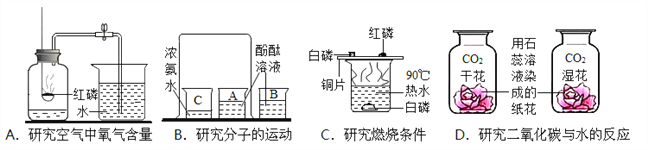
题目内容
【题目】对元素周期律的发现作出巨大贡献并编制了第一张元素周期表的是俄国化学家门捷列夫。下面是元素周期表的一部分。请回答
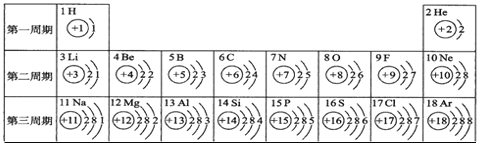
(1)原子序数为16的元素符号为________,它属于_______(填“金属”或“非金属”)元素。
(2)地壳中含量最多的金属元素是________,Mg元素和Cl元素组成的化合物的化学式为__________。
(3)在第三周期中,各原子核外电子排布的变化规律是________,Na、Mg、Al位于同一周期的原因是__________。
(4)氧原子在化学反应中易_______(填“得到”或“失去”)电子。氧元素和硫元素化学性质相似性的原因是它们原子的______相同。
(5)氧和氯两种元素最本质的区别是它们原子中的_______不同。
【答案】S; 非金属 铝(或Al); MgCl2 最外层电子数依次递增; 电子层数相同 得到; 最外层电子数; 质子数(或核电荷数)
【解析】
(1)由图可知,原子序数为16的元素为硫元素,其符号为S,它属于非金属元素;
(2)地壳中含量最多的金属元素是铝元素,元素符号为Al;Mg元素和Cl元素组成的化合物时,镁元素显+2价,氯元素显-2价,根据化合价原则,其化学式为MgCl2;
(3)在第三周期中,各原子核外电子排布的变化规律是最外层电子数依次递增;Na、Mg、Al位于同一周期的原因是电子层数相同;
(4)氧原子最外层电子数为6,大于4,故在化学反应中易得到电子;元素化学性质与其原子最外层电子数有关,氧元素和硫元素化学性质相似性的原因是它们原子的最外层电子数相同;
(5)元素是质子数相同的一类原子的总称,故氧和氯两种元素最本质的区别是它们原子中的质子数(核电荷数)不同。

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目