题目内容
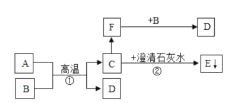
【题目】根据下面的装置图,回答下列问题:

(1)写出指定仪器的名称:a._____
(2)用装置A作为发生装置制取氧气,发生反应的化学方程式为_____,其中二氧化锰的作用是_____;可用D装置收集氧气,是因为氧气_____的性质,当看到_____现象时,说明氧气收满;
(3)实验室用溶质质量分数为20%的过氧化氢溶液和二氧化锰制氧气,并选用图B做发生装置时,同学们发现不能得到平稳的氧气流,大家提出从两方面加以改进:
一是选用图C做发生装置,其理由是_____;
二是加水稀释过氧化氢溶液,若把50g溶质质量分数为20%的过氧化氢溶液稀释成溶质质量分数为5%的过氧化氢溶液,需加水的质量为_____g;
(4)现有一瓶102g双氧水,加入适量二氧化锰,完全反应后生成氧气的物质的量为0.03mol,试计算参与反应的过氧化氢的物质的量和这瓶双氧水溶质质量分数。_____(写出计算过程)
【答案】锥形瓶 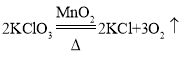 催化作用 不易溶于水 集气瓶口有气泡冒出 分液漏斗可以控制液体的滴加速度,进而可控制反应速率,得到平稳的氧气流 150g 0.06mol、2%
催化作用 不易溶于水 集气瓶口有气泡冒出 分液漏斗可以控制液体的滴加速度,进而可控制反应速率,得到平稳的氧气流 150g 0.06mol、2%
【解析】
(1)指定仪器的名称:a.锥形瓶。
(2)用装置A作为发生装置制取氧气,试管没有棉花,应为加热条件下二氧化锰催化氯酸钾反应生成氯化钾和氧气的反应,发生反应的化学方程式为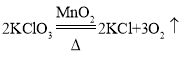 ,其中二氧化锰的作用是催化作用;可用D装置收集氧气,是因为氧气不易溶于水的性质,当看到集气瓶口有气泡冒出现象时,说明氧气收满;
,其中二氧化锰的作用是催化作用;可用D装置收集氧气,是因为氧气不易溶于水的性质,当看到集气瓶口有气泡冒出现象时,说明氧气收满;
(3)实验室用溶质质量分数为20%的过氧化氢溶液和二氧化锰制氧气,为得到稳定气流:
一是选用图C做发生装置,其理由是分液漏斗可以控制液体的滴加速度,进而可控制反应速率,得到平稳的氧气流;
二是加水稀释过氧化氢溶液,若把50g溶质质量分数为20%的过氧化氢溶液稀释成溶质质量分数为5%的过氧化氢溶液,设需加水的质量为x,根据溶液稀释前后溶质质量不变,![]() ,x=150g;
,x=150g;
(4)完全反应后生成氧气的物质的量为0.03mol,设参与反应的过氧化氢的物质的量为x,则

![]()
解得x=0.06mol;
参与反应的过氧化氢的质量为![]() ,这瓶双氧水溶质质量分数为
,这瓶双氧水溶质质量分数为![]() 。
。
答:参与反应的过氧化氢的物质的量为0.06mol,这瓶双氧水溶质质量分数为2%。

【题目】在学完氧气的性质后,某校课外小组同学对铁与氧气的反应进行了更深入地研究。

(1)实验1:在燃着的酒精上方抖落铁粉,观察到火星四射,如图所示。
①铁丝在空气中不能燃烧,铁粉却能在空气中燃烧,由此说明在某些工业生产中将原料粉碎的目的是_____。
②铁丝在空气中不能燃烧,在氧气中能燃烧,其燃烧的化学反应方程式为_____。
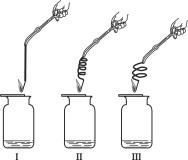
(2)实验2:用排水法收集等量的氧气作如下图所示实验,实验中所用的3根铁丝均从同1根长铁丝上截取,并且长度相同。
实验装置 | 实验现象 |
| 铁丝均燃烧,剧烈程度不同,II最剧烈,其次是III,较弱的是I。 |
①若实验中集气瓶底部不预留少量水,则可能造成的结果是______。
(3)实验3:用排水法收集等量的氧气,取不同型号的铁丝进行实验(铁丝的长度、绕成的螺旋圈数等相同)。
小资料:型号为304L、304、302铁丝,含碳量分别约为0.03%、0.08%、0.15%。
铁丝种类 | 实验现象 |
304L | 轻微火星四射 |
304 | 明显的火星四射 |
302 | 剧烈的火星四射 |
由该实验可得到的结论是:其他条件相同时,_____。