题目内容
在实验探究课上,老师给同学们一包红色粉未,该粉末是铜粉和氧化铁粉中的一种或两种。同学们为了确定该粉末的成分,进行如下探究。请回答下列问题。
【提出问题】红色粉末的成分是什么?
【猜想假设】猜想l:红色粉末是铜粉;
猜想2:红色粉末是氧化铁粉;
猜想3:红色粉末是 。
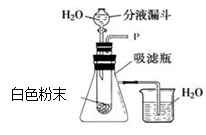
【设计方案】取少量红色粉末放入硬质玻璃管中,通入一氧化碳片刻后高温至充分反应(实验装置如下图所示)。

请你完成下表:
【实验结论】同学们进行了实验并经过分析,确认猜想3成立。
【反思评价】
(1)实验时通入一氧化碳片刻后再加热的原因是 。
(2)从环保角度看,上述装置有不足之处,具体的改进措施是 。
(3)请你用另一种反应原理证明猜想3成立,实验方案是 。
【提出问题】红色粉末的成分是什么?
【猜想假设】猜想l:红色粉末是铜粉;
猜想2:红色粉末是氧化铁粉;
猜想3:红色粉末是 。
【设计方案】取少量红色粉末放入硬质玻璃管中,通入一氧化碳片刻后高温至充分反应(实验装置如下图所示)。

请你完成下表:
| 实验中可能出现的现象 | 结论 |
| 红色粉末不变色,石灰水不变浑浊 | 猜想1成立 |
| | 猜想2成立 |
| | 猜想3成立 |
【反思评价】
(1)实验时通入一氧化碳片刻后再加热的原因是 。
(2)从环保角度看,上述装置有不足之处,具体的改进措施是 。
(3)请你用另一种反应原理证明猜想3成立,实验方案是 。
【猜想假设】铜粉和氧化铁粉
【设计方案】
【反思评价】
(1)防止加热时硬质玻璃管发生爆炸(或把玻璃管内空气排净)
(2)在b处用酒精灯点燃,或用塑料袋(气球)收集
(3)取少量红色粉于试管中,加入足量的稀盐酸充分反应, 试管底部有红色固体剩余,溶液变为黄色,则猜想3成立。(此空2分,必须有加点字的含义,否则不给分)
【设计方案】
| 实验中可能出现的现象 | 结论 |
| 红色粉末不变色,石灰水不变浑浊 | 猜想1成立 |
| 红色粉末全部变为黑色,石灰水变浑浊 | 猜想2成立 |
| 红色粉末部分变为黑色,石灰水变浑浊 | 猜想3成立 |
(1)防止加热时硬质玻璃管发生爆炸(或把玻璃管内空气排净)
(2)在b处用酒精灯点燃,或用塑料袋(气球)收集
(3)取少量红色粉于试管中,加入足量的稀盐酸充分反应, 试管底部有红色固体剩余,溶液变为黄色,则猜想3成立。(此空2分,必须有加点字的含义,否则不给分)
(1)根据题干的所给的信息可以作出判断;
(2)根据铜、氧化铁的性质来进行解答;
(4)①一氧化碳具有可燃性,当混有一定量的氧气时,达到着火点可能发生爆炸;
②一氧化碳有毒,能够污染空气,所以要放一个尾气处理装置;
③根据铜不和酸反应,氧化铁和酸生成的铁盐溶液有颜色进行解答
(2)根据铜、氧化铁的性质来进行解答;
(4)①一氧化碳具有可燃性,当混有一定量的氧气时,达到着火点可能发生爆炸;
②一氧化碳有毒,能够污染空气,所以要放一个尾气处理装置;
③根据铜不和酸反应,氧化铁和酸生成的铁盐溶液有颜色进行解答

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目