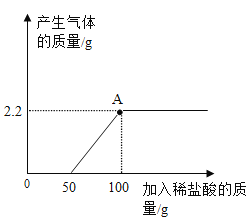
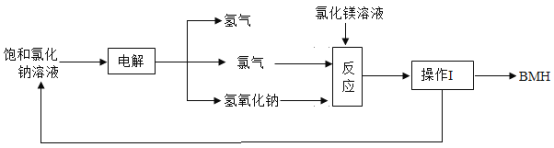
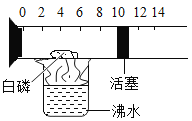
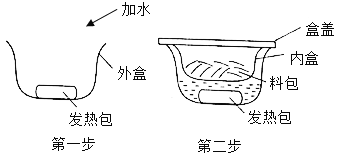
题目内容
【题目】已知 A 是固体碱式碳酸铜,其化学式是Cu2(OH)2CO3,它受热可分解为三种化合物,物质转化关系如图所示.其中 C、F、H、I是无色气体,B 通电时,在阴极产生I,在阳极产生 H.根据推断回答下列问题:
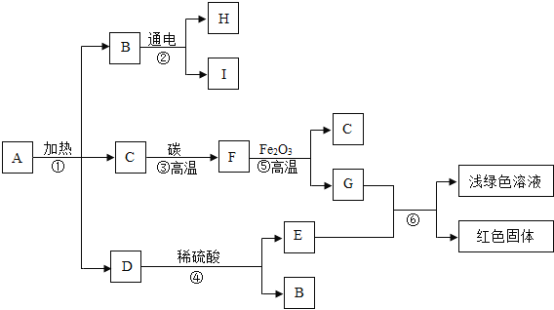
(1)铜锈的主要成分是碱式碳酸铜. 铜生锈与空气中氧气和水有关,还与空气中的_____________ (填化学式)有关;
(2)E 物质的化学式是_________;
(3)在①~⑥反应中属于化合反应的是_________ (填数字序号);
(4)反应⑤的化学方程式为 ________________,该反应体现了F 的_________性.
【答案】CO2 CuSO4 ③ 3CO+Fe2O3![]() 2Fe+3CO2 还原性
2Fe+3CO2 还原性
【解析】
B是碱式碳酸铜Cu2(OH)2CO3分解生成的化合物,B通电生成两种气体,故B为水,C为气体是二氧化碳,D为氧化铜,氧化铜和硫酸反应生成硫酸铜和水,故E为硫酸铜,二氧化碳和碳高温生成一氧化碳,F为一氧化碳,一氧化碳和氧化铁高温生成铁和二氧化碳,故G为铁,铁和硫酸铜反应生成硫酸亚铁和铜,红色固体为铜,浅绿色溶液为硫酸亚铁,水通电生成氢气和氧气,H、I一个是氢气一个是氧气,代入转化关系符合题意。
(1)铜锈的主要成分是碱式碳酸铜。铜生锈与空气中氧气和水有关,还与空气中的二氧化碳有关,故填:CO2。
(2)由分析可知E为硫酸铜,故填:CuSO4。
(3)①碱式碳酸铜受热分解生成水、二氧化碳、氧化铜,②水通电分解生成氢气和氧气,均符合“一变多”的特点,属于分解反应;③碳和二氧化碳高温生成一氧化碳,符合“多变一”特点,属于化合反应;④氧化铜与硫酸反应生成硫酸铜和水,是两种化合物互相交换成分生成另外两种化合物,属于复分解反应;⑤一氧化碳和氧化铁高温生成铁和二氧化碳,不属于基本反应类型;⑥铁和硫酸铜反应生成铜和硫酸亚铁,符合“一换一”的特点,属于置换反应。故填:③。
(4)由分析可知反应⑤一氧化碳和氧化铁高温生成铁和二氧化碳,化学方程式为3CO+Fe2O3![]() 2Fe+3CO2,该反应体现了一氧化碳的还原性,故填:3CO+Fe2O3
2Fe+3CO2,该反应体现了一氧化碳的还原性,故填:3CO+Fe2O3![]() 2Fe+3CO2;还原性。
2Fe+3CO2;还原性。

【题目】某化学兴趣小组将光亮铜片放在酒精灯火焰上灼烧,发现表面变黑,他们对黑色物质来源产生了兴趣,对铜片表面黑色物质的成分进行探究:
(查阅资料)(1)酒精不充分燃烧产生炭黑(即烟灰);
(2)氧气的化学性质比较活泼,加热条件下能与金属铜反应生成黑色的氧化铜。
(猜想与假设)
甲认为: ____________。
乙认为:铜片表面的黑色固体是空气中的氧气与铜反应生成的新物质。
丙认为:铜片表面的黑色固体既有烟灰又有氧气与铜反应生成的新物质。
(进行实验)
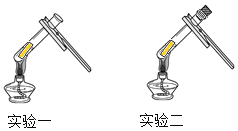
实验步骤和方法 | 实验现象 | 实验结论 |
实验一:取一小段光亮铜片,放入试管内,然后用试管夹夹持试管,放在酒精灯的外焰部位加热。 | 铜片变黑 | 甲、丙的猜想错误。说明黑色物质的出现可能与空气中的________有关。 |
实验二:取一试管,将一小段光亮铜片放入试管中,塞上胶塞,并用注射器抽出试管内的空气,封好胶塞,并加热,趁热取下胶塞,观察现象。 | 取下胶塞前的现象: _____。取下胶塞后的现象:___。 | 乙的猜想正确 |
(反思拓展)
(1)实验一将铜片放入试管中加热,目的是排除了______的干扰。
(2)实验二用注射器抽出试管内空气的目的是________。
(3)通过对黑色物质来源的探究,写出金属铜与氧气反应的化学方程式_____。