题目内容
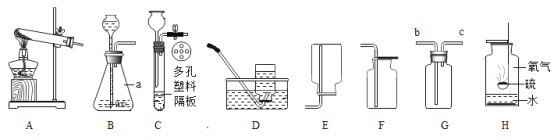
【题目】利用下图的装置,同学们在老师指导下探究了锌与浓硫酸的反应。(老师告知:①二氧化硫能使品红溶液褪色,B装置用于检验SO2。②浓硫酸与锌反应能生成二氧化硫,但不产生H2,也不会产生O2)请回答下列问题:
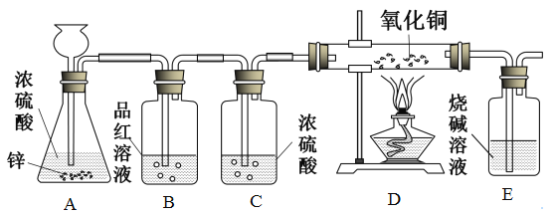
(1)C装置的作用是______
(2)E装置中反应的化学方程式是______。
(3)D装置在点燃酒精灯加热之前应先通一段时间的气体。目的是___;加热一段时间后,观察到____现象,证明气体中含有H2。
(4)锌和浓硫酸反应生成硫酸锌、水和二氧化硫,为什么反应过程中又产生了氢气呢?用文字简述原因:___。
(5)锌与浓硫酸、稀硫酸反应都可以产生硫酸锌,如果需要制取硫酸锌,用锌与稀硫酸反应的优点是______(任填一种合理的答案)。
【答案】干燥二氧化硫 ![]() 排尽装置中的空气,防止发生爆炸 D装置中黑色粉末逐渐变红 随着反应进行,浓硫酸浓度不断减小,逐渐变成稀硫酸,稀硫酸和锌反应生成硫酸锌和氢气 不产生有毒气体SO2
排尽装置中的空气,防止发生爆炸 D装置中黑色粉末逐渐变红 随着反应进行,浓硫酸浓度不断减小,逐渐变成稀硫酸,稀硫酸和锌反应生成硫酸锌和氢气 不产生有毒气体SO2
【解析】
(1)浓硫酸具有吸水性,C装置的作用是干燥二氧化硫。
(2)E装置中二氧化硫与氢氧化钠溶液反应生成亚硫酸钠和水,反应的化学方程式为:![]() 。
。
(3)氢气具有可燃性,D装置在点燃酒精灯加热之前应先通一段时间的气体,目的是排尽装置中的空气,防止发生爆炸。
氢气与氧化铜反应生成铜和水,加热一段时间后,观察到D装置中黑色粉末逐渐变红,证明气体中含有H2。
(4)锌和浓硫酸在反应过程中又产生了氢气,原因是:随着反应进行,浓硫酸浓度不断减小,逐渐变成稀硫酸,稀硫酸和锌反应生成硫酸锌和氢气。
(5)锌与浓硫酸和稀硫酸反应都可以产生硫酸锌,若要制取硫酸锌,用锌与稀硫酸反应的优点是不产生有毒气体。

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目