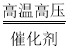题目内容
【题目】东营市拥有丰富的海洋资源,合理开发利用这些宝贵的资源将极大地促进东营市经济的发展。
(1)下图是将粗盐中的泥沙等不溶性杂质除去的基本操作。请回答相关问题:
![]()
其中操作1的名称是________;在过滤操作中要用到的玻璃仪器有烧杯、玻璃棒、_____(填仪器名称);在加热蒸发过程中,玻璃棒的作用是_______,当蒸发皿中出现较多固体时,停止加热。
(2)上述除去泥沙后的澄清滤液中,还含有Ca2+、Mg2+等阳离子。要想知道该滤液是硬水还是软水,可加入_______进行检验。
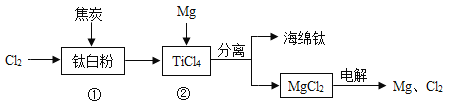
(3)海水提取出粗盐后的母液中,还含有较多的氯化镁,氯化镁是重要化工原料。下图是工业上从母液中提取氯化镁的过程:

反应Ⅰ的基本反应类型是________,该反应的方程式:_________;物质X是________(填名称)。
(4)工业上可用电解饱和NaCl溶液的方法制得烧碱、氯气和氢气,请写出该反应的化学方程式(反应条件为“通电”):__________。
【答案】溶解 漏斗 搅拌使液体受热均匀 肥皂水 复分解反应 MgCl2 + Ca(OH)2=Mg(OH)2↓+CaCl2 稀盐酸(或盐酸) 2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑
【解析】
(1)去除泥沙的步骤是:溶解、过滤、蒸发结晶,在过滤操作中要用到的玻璃仪器有烧杯、玻璃棒、漏斗,在加热蒸发过程中,玻璃棒的作用是防止局部温度过高而使液体飞溅;故填:溶解;漏斗;搅拌使液体受热均匀。
(2)硬水是指含有较多钙镁离子的水,软水是指含有较少钙镁离子的水.区分硬水和软水的方法是:用肥皂水,加入肥皂水,泡沫多的是软水,泡沫少的是硬水;故填:肥皂水;
(3)反应Ⅰ是氯化镁与氢氧化钙反应生成氯化钙和氢氧化镁沉淀,是两种化合物相互交换成分生成两种新的化合物的反应,属于复分解反应;反应Ⅱ将氢氧化镁转化成了氯化镁,应该加入稀盐酸;故填:复分解反应;MgCl2 + Ca(OH)2=Mg(OH)2↓+CaCl2;稀盐酸(或盐酸);
(4)工业生产通过电解饱和食盐水得到烧碱、氯气、氢气,反应的化学方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑.故填:2NaCl+2H2O
2NaOH+H2↑+Cl2↑.故填:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑。
2NaOH+Cl2↑+H2↑。

 计算高手系列答案
计算高手系列答案