题目内容
12.某含杂质的锌粒3克与足量的稀硫酸反应(杂质不与酸反应),在标准状况下可得到氢气0.898升(在标准状况下氢气的密度为0.09g/L),求该锌粒中杂质的质量分数.分析 锌与稀硫酸反应生成硫酸锌和氢气,由生成氢气的体积、密度,计算出生成氢气的质量,进而由反应的化学方程式计算出参加反应的锌的质量,进而计算出该锌粒中杂质的质量分数.
解答 解:生成氢气的质量为0.09g/L×0.898L≈0.08g.
设参加反应的锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.08g
$\frac{65}{2}=\frac{x}{0.08g}$ x=2.6g
该锌粒中杂质的质量分数为$\frac{3g-2.6g}{3g}×$100%≈13.3%.
答:该锌粒中杂质的质量分数为13.3%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,解题时要注意解题的规范性.

练习册系列答案
相关题目
17.下列关于氧气的说法中正确的是( )
| A. | 利用氧气与氮气的沸点不同,可用分离液态空气法制得纯净的氧气,此过程是物理变化 | |
| B. | 氧气在低温、高压的条件下可以转变为液体或固体 | |
| C. | 氧气是植物光合作用的重要来源 | |
| D. | 氧气的化学性质比较活泼,具有可燃性 |
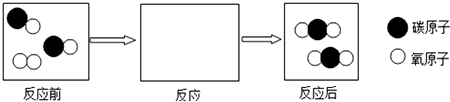
 物质在空气中燃烧,多数只与氧气反应,也有不同的,如镁在空气中燃烧不但与氧气反应,还与氮气和二氧化碳反应.如图是测定空气中燃烧氧气含量的装置图,燃烧匙内放入红磷,测得氧气约占空气总体积的$\frac{1}{5}$.
物质在空气中燃烧,多数只与氧气反应,也有不同的,如镁在空气中燃烧不但与氧气反应,还与氮气和二氧化碳反应.如图是测定空气中燃烧氧气含量的装置图,燃烧匙内放入红磷,测得氧气约占空气总体积的$\frac{1}{5}$.
 请用所学化学知识解释下列原理.
请用所学化学知识解释下列原理.