题目内容
【题目】某氯化钠样品中混有硫酸钠,为了除去硫酸钠并制得纯净的氯化钠固体,某同学设计如下方案:(步骤②③中加入试剂均过量)
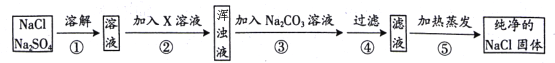
(1)此方案中,除去硫酸钠发生反应的化学方程式为_______________________。
(2)步骤④⑤中都要用到一种玻璃仪器,该仪器在步骤⑤中的作用是____________。
(3)小明同学认为此实验方案设计不严密,应该进行的改进措施是___________。
【答案】 Na2SO4 + BaCl2 ═ BaSO4↓ + 2NaCl 用玻璃棒不断搅拌,防止因局部温度过高造成液滴飞溅 在步骤④后的滤液中加足量稀盐酸
【解析】(1)要除去氯化钠中的硫酸钠,即要除去硫酸根离子,根据复分解反应发生的条件可将硫酸根转化为硫酸钡除去,故可加入氯化钡溶液。氯化钡与硫酸钠反应生成硫酸钡沉淀和氯化钠,反应的化学方程式表示为Na2SO4 + BaCl2 ═ BaSO4↓ + 2NaCl;(2)过滤和蒸发均需要用到玻璃棒,其中过滤时玻璃棒起引流的作用;蒸发时玻璃棒起搅拌的作用,目的是防止因局部温度过高造成液滴飞溅;(3)步骤2中加入氯化钡溶液生成硫酸钡沉淀和氯化钠,过量的氯化钡和用碳酸钠除去,碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠。由于加入的碳酸钠也是过量的,故过滤后得到的滤液中含有碳酸钠,应在步骤④后的滤液中加足量稀盐酸除去碳酸钠再进行蒸发得到纯净的氯化钠固体。

【题目】有一工业流程如下图所示:

(1)请将电石与水反应的化学方程式补充完整:
CaC2+2H2O=Ca(OH)2+________↑;
(2)有关物质常温下的溶解度如下表:
物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
上述流程中加入了KCl粉末,KCl与________(填化学式)发生了复分解反应得到KClO3晶体,该过程得到KClO3晶体的原因是____________。