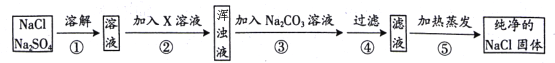题目内容
【题目】有一工业流程如下图所示:

(1)请将电石与水反应的化学方程式补充完整:
CaC2+2H2O=Ca(OH)2+________↑;
(2)有关物质常温下的溶解度如下表:
物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
上述流程中加入了KCl粉末,KCl与________(填化学式)发生了复分解反应得到KClO3晶体,该过程得到KClO3晶体的原因是____________。
【答案】 C2H2 Ca(ClO3)2 在常温下氯酸钾的溶解度较小,生成的氯酸钾过量会结晶析出
【解析】本题主要考查质量守恒定律,化学方程式的收写,溶解度。根据质量守恒定律写化学方程式,根据反应流程,判断找出能与氯化钾反应生成氯酸钾的物质,根据图中所给信息中氯酸钾的溶解度进行分析。
(1)根据质量守恒定律,化学反应前后原子的种类和数量不变判断另一种生成物是 C2H2.故填:C2H2
(2)由图分析,氯化钾只能与氯酸钙反应后成氯酸钾和氯化钙,由溶解度表可知氯酸钾在常温溶解度较小,故答案为:Ca(ClO3)2 在常温下氯酸钾的溶解度较小,生成的氯酸钾过量会结晶析出

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目