题目内容
如图是某试剂瓶标签上的内容.| 浓硫酸(分析纯) 化学式:H2SO4 相对分子质量:98 密度:1.84g∕cm3 质量分数;98% |
(2)将稀释后的硫酸溶液与200g氢氧化钠溶液恰好完全反应,求氢氧化钠溶液的溶质质量分数.
【答案】分析:(1)溶液加水稀释前后溶质的质量不变,根据稀释后所得溶液的质量可计算所需稀释前的浓溶液的质量;
(2)根据物质间的反应化学方程式以及溶质质量分数公式进行.
解答:解:(1)设需要98%的硫酸的质量为x,根据溶液加水稀释前后溶质的质量不变,可得
100g×19.6%=x×98%
x=20g
故答案为:20g;
(2)解:设与硫酸反应的氢氧化钠的质量为x,则
2NaOH+H2SO4═Na2SO4+2H2O
80 98
x 100g×19.6%
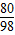 =
=
解得x=16g
因此氢氧化钠溶液的溶质质量分数为: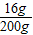 ×100%=8%.
×100%=8%.
答:氢氧化钠溶液的溶质质量分数为8%.
点评:本题考查了有关溶液稀释的计算和浓硫酸的稀释,可以依据稀释前后溶质的质量不变解决,利用化学方程式表示物质质量关系的含义,根据反应中某一物质的质量可计算反应中其它物质的质量.
(2)根据物质间的反应化学方程式以及溶质质量分数公式进行.
解答:解:(1)设需要98%的硫酸的质量为x,根据溶液加水稀释前后溶质的质量不变,可得
100g×19.6%=x×98%
x=20g
故答案为:20g;
(2)解:设与硫酸反应的氢氧化钠的质量为x,则
2NaOH+H2SO4═Na2SO4+2H2O
80 98
x 100g×19.6%
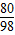 =
=
解得x=16g
因此氢氧化钠溶液的溶质质量分数为:
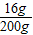 ×100%=8%.
×100%=8%.答:氢氧化钠溶液的溶质质量分数为8%.
点评:本题考查了有关溶液稀释的计算和浓硫酸的稀释,可以依据稀释前后溶质的质量不变解决,利用化学方程式表示物质质量关系的含义,根据反应中某一物质的质量可计算反应中其它物质的质量.

练习册系列答案
相关题目
如图是某试剂瓶标签上的内容.
| 浓硫酸(分析纯) 化学式:H2SO4 相对分子质量:98 密度:1.84g∕cm3 质量分数;98%(1)把这种浓硫酸稀释为溶质质量分数是19.6%的硫酸溶液100g,需要这种硫酸的质量为 20g 20g (2)将稀释后的硫酸溶液与200g氢氧化钠溶液恰好完全反应,求氢氧化钠溶液的溶质质量分数. |
 如图是某试剂瓶标签上的内容.
如图是某试剂瓶标签上的内容.
