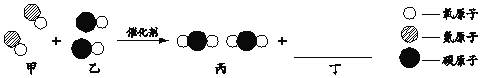题目内容
【题目】下列排序正确的是 ( )
A. 空气中物质的含量:![]() B. 相对分子质量;
B. 相对分子质量;![]()
C. 氮元素的化合价:![]() D. 硫元素的质量分数:
D. 硫元素的质量分数:![]()
【答案】B
【解析】
A. 空气中各成分的含量按体积分数计算,氮气占78%,氧气占21%,稀有气体占0.94%,二氧化碳占0.03%,选项错误;
B. 相对分子质量;氢气:1×2=2,氨气:1×14+1×3=17,二氧化硫:1×32+2×16=64,选项正确;
C. 单质中元素的化合价为零,化合物中元素的化合价代数和为零,氮元素的化合价:氮气中是0,氨气中氢元素为+1价,氮元素的化合价为-3价,氢元素显+1价,氧元素显-2价,硝酸中氮元素的化合价为+5,选项错误;
D. ![]() ,硫化钠中硫元素的质量分数
,硫化钠中硫元素的质量分数![]() 亚硫酸钠中硫元素的质量分数
亚硫酸钠中硫元素的质量分数![]() ,硫酸钠中硫元素的质量分数
,硫酸钠中硫元素的质量分数![]() 三种物质中硫的质量分数逐渐减小,选项错误。故选B。
三种物质中硫的质量分数逐渐减小,选项错误。故选B。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】小婧同学学习化学后知道,镁在氧气中燃烧会生成白色的氧化镁固体,该反应的化学方程式为__________;但她在空气中点燃镁条时,发现生成的白色固体中还夹杂着少量的淡黄色固体。
(提出问题)为什么会生成淡黄色固体?
(查阅资料)小婧查阅资料,记录了下列几种物质的颜色:
物质 | MgO | MgCl2 | Mg3N2 | Mg(NO3)2 |
颜色 | 白色 | 白色 | 淡黄色 | 白色 |
其他同学认为不需要查询________的颜色,理由是__________。
(提出猜想)分析资料,小茜认为淡黄色固体可能是由镁与空气中的氮气反应生成的。
(实验探究)
实验操作 | 实验现象 | 实验结论和化学方程式 |
__________ | ______ | 小茜的猜想成立,化学方程式为 _________。 |
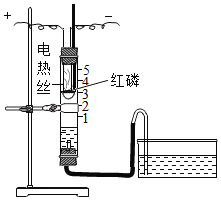
【题目】利用如图装置进行空气中氧气含量测定实验。
实验装置 | 实验操作 |
| I.向玻璃管和水槽内加适量的水,在燃烧匙里放足量红磷,塞紧塞子,上下移动水槽至两边水面相平于玻璃管的零刻度位置。 II.接通电源,待红磷燃烧,断开电源。 III.当温度恢复至室温,水不再进入玻璃管时,上下移动水槽至两边水面相平。 |
(1)实验中加入足量红磷的目的是_____,该实验中发生反应的化学方程式为_____。
(2)实验结束后,玻璃管内水面最终到达刻度线_____(填数字序号)处。
(3)实验操作I、III中,上下移动水槽至两边水面相平的目的是_____。