题目内容
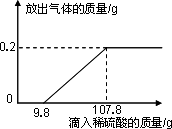
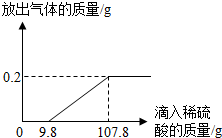 在烧杯中加入2.14g久置于空气中的铝箔,再滴加稀硫酸,放出气体的质量与所加稀硫酸质量的关系如图所示.请回答下列问题:
在烧杯中加入2.14g久置于空气中的铝箔,再滴加稀硫酸,放出气体的质量与所加稀硫酸质量的关系如图所示.请回答下列问题:(1)与氧化铝反应的稀硫酸是
9.8
9.8
g,与铝反应的稀硫酸是98
98
g.(2)所滴加的稀硫酸中溶质的质量分数.
(3)该铝箔中铝元素的质量.
分析:由于铝的化学性质比较活泼,易于空气中的氧气反应,在铝的表面形成了氧化铝,所以开始加入硫酸时不产生氢气.当加入9.8g稀硫酸时才产生氢气,当加稀硫酸的量至107.8g时,铝箔和硫酸恰好完全反应,产生0.2g氢气.根据铝箔和稀硫酸反应化学方程式,由氢气的质量,可求出与铝反应的硫酸中溶质的质量,再求出所滴加的稀硫酸中溶质的质量分数;依据硫酸最终会转化为硫酸铝,且硫酸根的质量守恒可得铝元素的质量;
解答:解:(1)由于在铝的表面形成了氧化铝,所以开始加入硫酸时不产生氢气.从图象可以看出与氧化铝反应的稀硫酸的质量是9.8g,当加稀硫酸的量至107.8g时,铝箔和硫酸恰好完全反应,产生0.2g氢气.所以与铝反应的稀硫酸是107.8g-9.8g=98g;
(2)设与铝反应的稀硫酸中溶质的质量为x.
2Al+3H2SO4═Al2(SO4)3+3H2↑
294 6
x 0.2g
=
x=9.8g
稀硫酸中溶质的质量分数为:
×100%=10%
(3)设铝元素的质量是y
=
y=19.8g
故答案为:(1)9.8;98;(2)所滴加的稀硫酸中溶质的质量分数为10%.(3)该铝箔中铝元素的质量是19.8g.
(2)设与铝反应的稀硫酸中溶质的质量为x.
2Al+3H2SO4═Al2(SO4)3+3H2↑
294 6
x 0.2g
| 294 |
| x |
| 6 |
| 0.2g |
x=9.8g
稀硫酸中溶质的质量分数为:
| 9.8g |
| 98g |
(3)设铝元素的质量是y
| y | ||
107.8g×
|
| 27×2 |
| 288 |
y=19.8g
故答案为:(1)9.8;98;(2)所滴加的稀硫酸中溶质的质量分数为10%.(3)该铝箔中铝元素的质量是19.8g.
点评:此题考查学生会结合图示找出解题突破口,利用化学方程式进行计算,特别是解2步时,首先化学方程式要正确,再者相对分子质量要计算正确,才能解出正确的答案.请同学们考虑细致,思维要慎密.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目