题目内容
(2012?揭阳)工业上用煅烧石灰石(主要成分为CaCO3)制取生石灰,其生产流程图如下: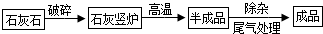
(1)某工厂用12t含碳酸钙为75%的石灰石,其中所含碳酸钙的质量是
(2)上述石灰石理论上可以制得生石灰多少t?(写出计算过程)

(1)某工厂用12t含碳酸钙为75%的石灰石,其中所含碳酸钙的质量是
9
9
t.(2)上述石灰石理论上可以制得生石灰多少t?(写出计算过程)
分析:(1)根据碳酸钙的含量进行解答.
(1)可根据第一问碳酸钙的质量,利用碳酸钙分解的化学方程式进行解答.
(1)可根据第一问碳酸钙的质量,利用碳酸钙分解的化学方程式进行解答.
解答:解:(1)碳酸钙的质量=12t×75%=9t;
故填:9;
(2)设生成氧化钙的质量为x.则
CaCO3
CaO+CO2↑
100 56
9t x
=
,
解之得:x=5.04t
因为生成的生石灰中含有未参与反应的杂质,杂质的质量=12t×(1-75%)=3t
所以最终可以生产生石灰的质量=5.04t+3t=8.04t
答:可生产生石灰8.04t.
故填:9;
(2)设生成氧化钙的质量为x.则
CaCO3
| ||
100 56
9t x
| 100 |
| 9t |
| 56 |
| x |
解之得:x=5.04t
因为生成的生石灰中含有未参与反应的杂质,杂质的质量=12t×(1-75%)=3t
所以最终可以生产生石灰的质量=5.04t+3t=8.04t
答:可生产生石灰8.04t.
点评:本题主要考查了学生解决有关含杂质物质的化学反应的计算的能力,解题关键是求反应后物质的质量时,既要考虑生成的物质,又要考虑原混合物中没有参加反应的物质.

练习册系列答案
相关题目