题目内容
我们每年要向自然界索取大量的金属矿物资源,然而矿物的储量是有限的,不能再生,保护金属资源的有效途径是:①防止金属的锈蚀;②回收利用废旧金属;③禁止开采矿物;④寻找金属代用品
- A.①②③④
- B.①②③
- C.①③
- D.①②④
D
分析:保护金属资源的有效途径要从开采、防止生锈、寻找替代品、回收再利用等方面考虑,回收再利用可节约原料节省能源,是一种保护金属资源的有效途径.
解答:保护金属资源的有效途径有:防止金属的锈蚀,由于金属锈蚀而浪费的金属约占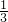 ,要想方设法防止金属生锈;回收再利用可节约原料节省能源,是一种保护金属资源的有效途径,要回收利用废旧金属;要合理开采矿物而不是禁止开采;寻找金属代用品可减少金属的利用率,节约了金属资源.
,要想方设法防止金属生锈;回收再利用可节约原料节省能源,是一种保护金属资源的有效途径,要回收利用废旧金属;要合理开采矿物而不是禁止开采;寻找金属代用品可减少金属的利用率,节约了金属资源.
故选D.
点评:通过回答本题知道了保护金属资源的有效途径是:防止金属的锈蚀,回收利用废旧金属,合理开采矿物,寻找金属代用品.
分析:保护金属资源的有效途径要从开采、防止生锈、寻找替代品、回收再利用等方面考虑,回收再利用可节约原料节省能源,是一种保护金属资源的有效途径.
解答:保护金属资源的有效途径有:防止金属的锈蚀,由于金属锈蚀而浪费的金属约占
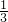 ,要想方设法防止金属生锈;回收再利用可节约原料节省能源,是一种保护金属资源的有效途径,要回收利用废旧金属;要合理开采矿物而不是禁止开采;寻找金属代用品可减少金属的利用率,节约了金属资源.
,要想方设法防止金属生锈;回收再利用可节约原料节省能源,是一种保护金属资源的有效途径,要回收利用废旧金属;要合理开采矿物而不是禁止开采;寻找金属代用品可减少金属的利用率,节约了金属资源.故选D.
点评:通过回答本题知道了保护金属资源的有效途径是:防止金属的锈蚀,回收利用废旧金属,合理开采矿物,寻找金属代用品.

练习册系列答案
相关题目
 某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.
某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.
(一)有关资料
原料岩盐水主要是含NaCl,此外还含有较多Na2SO4,以及少量CaCl2和MgCl2.
上述几种物质在不同温度时的溶解度数据如下表:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶 解 度 /g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2SO4 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 | |
| CaCl2 | 59.5 | 65.0 | 74.5 | 100 | 116 | |
| MgCl2 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 | |
(二)生产工艺

(2)“降温”的目的是析出副产品“A晶体”,A的化学式是________;
(3)反应器中的反应为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.再将NaHCO3晶体转移出来后,加热所得固体即为工业纯碱.在整个生产工艺中没有涉及到的基本反应类型是________,可重复利用的是________(水除外,只需一种);
(4)在反应器中总是先通氨气,后通二氧化碳,原因是________.
(三)工业纯碱中杂质的判断:
(5)已知:NH4Cl NH3↑+HCl↑
实验步骤:
①取一定质量的纯碱样品,经多次充分加热后再称重,发现质量无变化;
②另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
由上述实验可确定纯碱样品含有杂质________(写化学式).
(四)含量测定
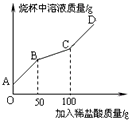
(6)称取纯碱样品21.3g于烧杯中,加入适量水将其溶解,然后逐滴加入溶质质量分数为14.6%的稀盐酸并不断用玻璃棒搅拌.先发生反应:Na2CO3+HCl=NaHCO3+NaCl;后发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑.在上述过程中烧杯中溶液质量与加入稀盐酸质量的关系如图所示(不考虑CO2的溶解),请你根据图甲提供的信息计算检测过程中产生CO2的质量________.
(7)请通过计算并结合表判断此纯碱样品等级为________品.
| 工业纯碱标准(Na 2CO3%≥) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |