题目内容
 某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.
某制碱厂以岩盐水为主要原料生产纯碱(Na2CO3)和其他副产品.
(一)有关资料
原料岩盐水主要是含NaCl,此外还含有较多Na2SO4,以及少量CaCl2和MgCl2.
上述几种物质在不同温度时的溶解度数据如下表:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | |
| 溶 解 度 /g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2SO4 | 4.5 | 9.6 | 20.2 | 40.8 | 48.4 | |
| CaCl2 | 59.5 | 65.0 | 74.5 | 100 | 116 | |
| MgCl2 | 52.9 | 53.8 | 54.8 | 56.0 | 58.0 | |
(二)生产工艺

(2)“降温”的目的是析出副产品“A晶体”,A的化学式是________;
(3)反应器中的反应为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl.再将NaHCO3晶体转移出来后,加热所得固体即为工业纯碱.在整个生产工艺中没有涉及到的基本反应类型是________,可重复利用的是________(水除外,只需一种);
(4)在反应器中总是先通氨气,后通二氧化碳,原因是________.
(三)工业纯碱中杂质的判断:
(5)已知:NH4Cl NH3↑+HCl↑
实验步骤:
①取一定质量的纯碱样品,经多次充分加热后再称重,发现质量无变化;
②另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.
由上述实验可确定纯碱样品含有杂质________(写化学式).
(四)含量测定
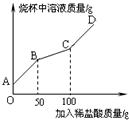
(6)称取纯碱样品21.3g于烧杯中,加入适量水将其溶解,然后逐滴加入溶质质量分数为14.6%的稀盐酸并不断用玻璃棒搅拌.先发生反应:Na2CO3+HCl=NaHCO3+NaCl;后发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑.在上述过程中烧杯中溶液质量与加入稀盐酸质量的关系如图所示(不考虑CO2的溶解),请你根据图甲提供的信息计算检测过程中产生CO2的质量________.
(7)请通过计算并结合表判断此纯碱样品等级为________品.
| 工业纯碱标准(Na 2CO3%≥) | ||
| 优等品 | 一等品 | 合格品 |
| 99.2 | 98.8 | 98.0 |
解:(1)由表中的数据可知,在10℃时,Na2SO4的溶解度是9.6g,饱和Na2SO4溶液中溶质的质量分数是: ×100%=8.8%;
×100%=8.8%;
(2)由表中的数据可知,Na2SO4的溶解度随温度的升高变化最大,所以在降温时.析出晶体最多的A是Na2SO4;
(3)由生产工艺可知,在精制盐水Ⅰ中氢氧化钙与氯化镁反应:MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2,该反应属于复分解反应;反应器中的反应为:NH3+CO2+H2O=NH4HCO3,反应为化合反应.加热碳酸氢钠制取纯碱的化学方程式:2NaHCO3 Na2CO3+H2O+CO2↑属于分解反应,所以.没有涉及到的反应是置换反应,由生产工艺可知CO2、NaCl可以重复使用;
Na2CO3+H2O+CO2↑属于分解反应,所以.没有涉及到的反应是置换反应,由生产工艺可知CO2、NaCl可以重复使用;
(4)在反应器中总是先通氨气,后通二氧化碳,原因是:因为氨气易溶与水,形成碱性环境便于二氧化碳溶解;
(5)由向少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.可确定纯碱样品含有杂质NaCl;
(6)根据据图甲可以看出,当加入盐酸的量为50g时开始产生二氧化碳,当加入盐酸的量为100g时不再生成二氧化碳,设产生二氧化碳的质量为x,则有
NaHCO3+HCl=NaCl+H2O+CO2↑.
36.5 44
50g×14.6% x
36.5:50g×14.6%=44:x
解得,x=8.8g
(7)根据题意可以看出,与碳酸钠反应的盐酸共有100g,设碳酸钠的质量为y,则有
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73
y 100g×14.6%
106:y=73:100g×14.6%
解得,y=21.2g,
所以该样品中纯碱的质量分数为: ×100%=99.5%>99.28%,属于优等品
×100%=99.5%>99.28%,属于优等品
故答为:(1)8.8%;(2)Na2SO4;(3)置换反应,CO2(或NaCl);(4)氨气易溶与水,形成碱性环境便于二氧化碳溶解;(5)NaCl;(6)8.8g;(7)优等.
分析:(1)根据10℃时,Na2SO4的溶解度计算饱和Na2SO4溶液中溶质的质量分数;
(2)根据NaCl、Na2SO4、CaCl2、MgCl2的溶解度随温度的变化情况分析;
(3)根据在整个生产工艺中涉及到的反应及反应的类型分析未涉及到的反应,根据整个生产工艺分析可重复利用的物质;
(4)根据氨气易溶于水形成氨水显碱性,与二氧化碳溶于水形成的碳酸反应分析;
(5)根据氯离子的检验方法分析;
(6)根据图象分析能产生二氧化碳的盐酸的质量,有盐酸的质量求出二氧化碳的质量;
(7)要判断此纯碱样品等级,就要计算碳酸钠的质量分数,需要求得碳酸钠的质量.
点评:本题难度较大,主要考查了物质的分离操作和除去杂质的方法,要根据物质的性质选择适当的方法进行解答,培养学生对知识的应用和理解的能力;在书写化学方程式及计算过程一定要规范.
 ×100%=8.8%;
×100%=8.8%;(2)由表中的数据可知,Na2SO4的溶解度随温度的升高变化最大,所以在降温时.析出晶体最多的A是Na2SO4;
(3)由生产工艺可知,在精制盐水Ⅰ中氢氧化钙与氯化镁反应:MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2,该反应属于复分解反应;反应器中的反应为:NH3+CO2+H2O=NH4HCO3,反应为化合反应.加热碳酸氢钠制取纯碱的化学方程式:2NaHCO3
 Na2CO3+H2O+CO2↑属于分解反应,所以.没有涉及到的反应是置换反应,由生产工艺可知CO2、NaCl可以重复使用;
Na2CO3+H2O+CO2↑属于分解反应,所以.没有涉及到的反应是置换反应,由生产工艺可知CO2、NaCl可以重复使用;(4)在反应器中总是先通氨气,后通二氧化碳,原因是:因为氨气易溶与水,形成碱性环境便于二氧化碳溶解;
(5)由向少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.可确定纯碱样品含有杂质NaCl;
(6)根据据图甲可以看出,当加入盐酸的量为50g时开始产生二氧化碳,当加入盐酸的量为100g时不再生成二氧化碳,设产生二氧化碳的质量为x,则有
NaHCO3+HCl=NaCl+H2O+CO2↑.
36.5 44
50g×14.6% x
36.5:50g×14.6%=44:x
解得,x=8.8g
(7)根据题意可以看出,与碳酸钠反应的盐酸共有100g,设碳酸钠的质量为y,则有
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 73
y 100g×14.6%
106:y=73:100g×14.6%
解得,y=21.2g,
所以该样品中纯碱的质量分数为:
 ×100%=99.5%>99.28%,属于优等品
×100%=99.5%>99.28%,属于优等品故答为:(1)8.8%;(2)Na2SO4;(3)置换反应,CO2(或NaCl);(4)氨气易溶与水,形成碱性环境便于二氧化碳溶解;(5)NaCl;(6)8.8g;(7)优等.
分析:(1)根据10℃时,Na2SO4的溶解度计算饱和Na2SO4溶液中溶质的质量分数;
(2)根据NaCl、Na2SO4、CaCl2、MgCl2的溶解度随温度的变化情况分析;
(3)根据在整个生产工艺中涉及到的反应及反应的类型分析未涉及到的反应,根据整个生产工艺分析可重复利用的物质;
(4)根据氨气易溶于水形成氨水显碱性,与二氧化碳溶于水形成的碳酸反应分析;
(5)根据氯离子的检验方法分析;
(6)根据图象分析能产生二氧化碳的盐酸的质量,有盐酸的质量求出二氧化碳的质量;
(7)要判断此纯碱样品等级,就要计算碳酸钠的质量分数,需要求得碳酸钠的质量.
点评:本题难度较大,主要考查了物质的分离操作和除去杂质的方法,要根据物质的性质选择适当的方法进行解答,培养学生对知识的应用和理解的能力;在书写化学方程式及计算过程一定要规范.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目

 如图是实验室制取气体的常见装置,请回答下列问题.
如图是实验室制取气体的常见装置,请回答下列问题. 正确地认识物质间的联系和区别是学好化学的重要方法之一.如图是小朋同学归纳的知识网络图.请根据该图回答:
正确地认识物质间的联系和区别是学好化学的重要方法之一.如图是小朋同学归纳的知识网络图.请根据该图回答: 如图是熟石灰的溶解度曲线图,请依据图示信息回答有关问题:
如图是熟石灰的溶解度曲线图,请依据图示信息回答有关问题:



