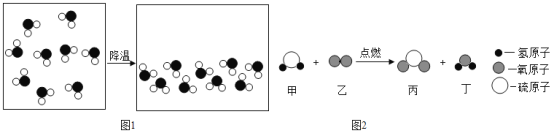
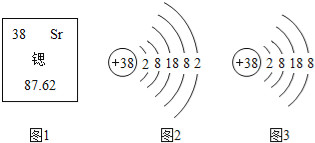
题目内容
【题目】如图是甲、乙两种固体物质的溶解度曲线.

(1)t2℃时,甲乙两种物质的溶解度的大小关系为_____;
(2)从图中你还能获得哪些信息?(任填一条)_____;
(3)t2℃时,将16g甲物质放入50g水中,充分溶解后所得的溶液是_____(填“饱和”或“不饱和”)溶液.欲使t2℃时乙物质的饱和溶液变为不饱和溶液,可采取的方法_____(任填一种方法).
【答案】甲>乙 甲的溶解度随温度的升高而增大明显 饱和 加水
【解析】
(1)据图可以知道,在t2℃时,甲的溶解度大于乙的溶解度,故填:甲>乙;
(2)据图可以看出,甲的溶解度随温度的升高而增大明显,故填:甲的溶解度随温度的升高而增大明显;
(3)t2℃时,甲的溶解度是30g,将16g甲物质放入50g水中,充分溶解后只能溶解15g,所得的溶液是饱和溶液;使t2℃时乙物质的饱和溶液变为不饱和溶液,
采取加入水的方法,故填:饱和,加水.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】做完“铁在氧气里燃烧”实验后,小明同学有两个疑惑不解的问题,于是他进行了以下探究活动,请你一同参与.
(问题)铁燃烧时溅落下来的黑色物质中还有没有铁呢?
(查阅资料)(1)自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3)
(2)铁的氧化物均能溶于酸的溶液.
(实验探究)将冷却后的黑色物质碾碎,装入试管,加入 ______ 溶液,观察到的现象是 ______,说明铁燃烧时溅落下来的黑色物质中还含有铁.
(问题)铁燃烧的产物为什么不是 Fe2O3呢?
(查阅资料)
(1)Fe3O4和Fe2O3分解温度、铁的熔点见表:
Fe3O4 | Fe2O3 | 铁 | |
分解温度/℃ | 1538 | 1400 |
|
熔点/℃ |
|
| 1535 |
(2)Fe2O3高温时分解成Fe3O4
(理论探讨)根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在 ______ 之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产生是Fe3O4.
(拓展研究)
(1)实验中为了防止集气瓶炸裂,必须 ______.
(2)Fe2O3高温时会分解成Fe3O4和一种气体,请写出此反应的化学方程式 ______.
(3)有些超市的食品密封包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色______,就说明包装盒破损进气,这样售货员就能及时发现并处理.
【题目】化学反应条件的控制是实验的灵魂”.某探究小组发现若反应过快,产生的气体不易及时收集,为探究影响过氧化氢溶液分解快慢的因素,于是进行了如下探究:
(提出问题)过氧化氢溶液分解快慢与哪些因素有关呢?
(猜想与假设)猜想一:可能与过氧化氢的质量分数有关;
猜想二:可能与____有关;
猜想三:可能与是否用催化剂有关.
(设计并实验)该探究小组用不同质量分数的过氧化氢溶液在不同温度时进行四次实验.记录所生成的氧气体积和反应所需时间,记录数据如表.
实验 序号 | 过氧化氢的 质量分数 | 过氧化氢溶液 体积(mL) | 温度 | 二氧化锰 的用量/g | 收集氧气 的体积/ml | 反应所需 的时间/s |
① | 5% | 1 | 20 | 0.1 | 4 | 16.75 |
② | 15% | 1 | 20 | 0.1 | 4 | 6.04 |
③ | 30% | 5 | 35 | 2 | 49.21 | |
④ | 30% | 5 | 55 | 2 | 10.76 |
(收集证据)要比较不同质量分数的过氧化氢溶液对反应快慢的影响,应选择的实验编号组合是_____(选填“实验序号”).由实验③和④对比可知,化学反应速率与温度的关系是:________./span>
(解释与结论)
(1)通过探究,了解控制过氧化氢分解快慢的方法.请写出过氧化氢溶液在二氧化锰的催化作用下生成氧气的文字表达式为:_____________.
(2)用一定量15%的过氧化氢溶液制氧气,为了减缓反应速率,可加适量的水稀释,所产生氧气的总质量_________.(填“减小”、“增大”或“不变”)