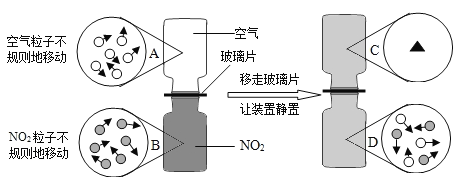
题目内容
【题目】某兴趣小组在实验室里做制取氢气的实验,取6.5g锌和93.7g稀硫酸放入同一烧杯中,恰好完全反应。请计算:(写出计算过程)
(1)生成氢气的质量_____
(2)反应后所得溶液中溶质的质量分数。_____
【答案】0.2克 16.1%
【解析】
根据题中的叙述列出化学方程式,再依据所给数据和设出的数据找出比例关系进行解答,最后将解出的答案进行总结即可。6.5g是纯锌的质量,而93.7g是溶液的质量,所以可以直接使用6.5g,而不可以用93.7g带入化学方程式计算。
(1)解:设可产生氢气的质量为x,生成的ZnSO4的质量为y
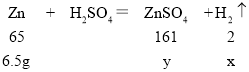
![]()
x=0.2g,y=16.1g;故填:0.2克
(2)溶液中溶质的质量分数为:![]() 。故填:16.1%
。故填:16.1%

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
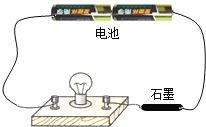
百强名校期末冲刺100分系列答案【题目】回答实验室用高锰酸钾制取氧气的相关问题。
(1)写出制取原理的符号表达式_____________.
(2)如下图所示,若要制取并收集一瓶干燥的氧气,应选用______(填编号,下同)
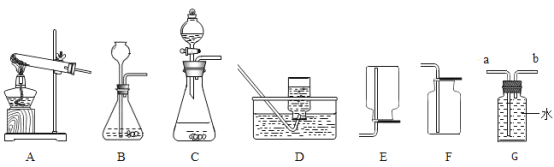
(3)实验室在常温下用块状电石与水反应制取微溶于水的乙炔气体,该反应必须严格控制加水速度,以免剧烈反应放热引起装置炸裂。你认为上图中最适合制取乙炔气体的发生装置是___;如果用图G所示装置收集乙炔,气体应从___(填“a”或“b”)端口通入。
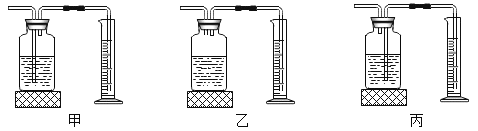
(4)为测定高锰酸钾分解生成氧气的体积,应选用下图装置___(填编号).
(5)实验结束,某同学发现收集到的纯氧气质量大于通过计算所得质量。不考虑实验误差,请你就此提出一种猜想并设计相应验证方案:
猜想 | 验证方案 |
___________________________ | ___________________________ |
【题目】为了解AB两种金属在常见金属活动性顺序表中的位置,设计以下实验:
实验一 | 实验二 | 实验三 | |
实验操作 | 将AB分别伸入稀盐酸 | 将A伸入B的盐溶液中 | 将B伸入A的盐溶液中 |
实验现象 | 均无明显现象 | 红色的A表面有银白色固体析出 | ________现象 |
由上述现象可知,下列判断正确的是 ( )
A.![]() B.
B.![]() C.A、B可能是铜锌D.实验三有固体析出
C.A、B可能是铜锌D.实验三有固体析出