题目内容
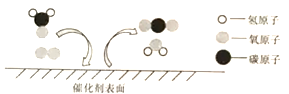
【题目】在催化剂作用下,二氧化碳能高效转化为甲醇(CH3OH),相关反应如下图所示,其中“![]() ”、“
”、“ ![]() ”、“
”、“ ![]() ”表示不同的原子。下列说法错误的是
”表示不同的原子。下列说法错误的是

A. 该反应的四种物质中有两种氧化物
B. 该反应前后氢元素的化合价改变
C. 该反应的催化剂在反应前后化学性质不改变
D. 参加反应的乙和生成的丙的质量比为1∶16
【答案】D
【解析】
由二氧化碳高效转化为甲醇相关反应图和质量守恒定律可知,该反应的反应物是二氧化碳和氢气,生成物是甲醇和水,化学方程式是:CO2+3H2 CH3OH+H2O。
CH3OH+H2O。
A、氧化物是由两种元素组成的化合物,且其中一种元素是氧元素,因此该反应中的二氧化碳和水属于氧化物,故A正确;
B、在反应物氢气中的氢元素显0价,生成物水中的氢元素显+1价,该反应前后氢元素的化合价改变,故B正确;
C、由催化剂的概念可知,该反应的催化剂在反应前后化学性质与质量不改变,故C正确;
D、根据化学方程式可知,在反应中,氢气与甲醇的质量比=(2×3):32=3:16,故D错误。故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】小组同学在探究金属与酸反应时,将铝片、锌片打磨后,分别投入盛有等体积、等浓度稀盐酸的试管中,观察到铝与稀盐酸反应较锌与稀盐酸反应快。
【提出问题】金属与盐酸反应快慢,除与金属的种类有关外,还受哪些因素的影响呢?
【猜想与假设】a.可能与盐酸的浓度有关;b. 可能与反应时的温度有关。
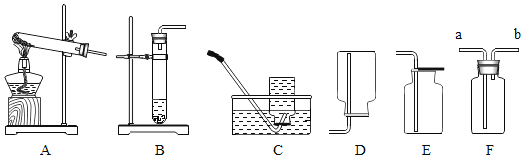
【设计并实验】小明利用如图甲所示装置,用不同质量分数的盐酸和相同形状的锌片进行如下实验。
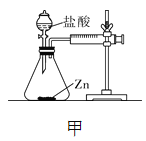
实验编号 | 盐酸的质量分数(均取20 mL) | 温度/℃ | 记录的数据 |
① | 5% | 30 | |
② | 10% | 20 | |
③ | 5% | 20 | |
④ | 10% | 30 |
【讨论】(1)写出锌与稀盐酸反应的化学方程式__________。
(2)实验时,需将金属片打磨,其目的是__________。
(3)实验前小明先将分液漏斗的活塞关闭,再将注射器活塞往右拉,松手后,观察到注射器活塞回到原处。小明进行该操作的目的是______________。
【分析数据、得出结论】
(4)实验中记录的数据可能是_____________。
(5)对比实验________可知温度对金属与酸反应的速率的影响。
(6)实验表明,四次实验时,反应的速率由快到慢依次为④、②、①、③。根据记录的数据分析,如果盐酸质量分数为10%,温度为25℃,则所记录数据应该介于哪两次实验所记录的数据之间?________________________。
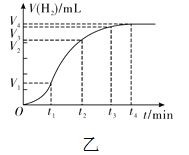
【拓展】进行锌与稀盐酸反应时,试管外壁发烫,并测得实验过程中生成氢气的体积随时间变化的曲线如图乙所示,根据曲线归纳锌与稀盐酸反应速率的变化规律______________,结合上述探究解释曲线变化的原因 ________________________________。