题目内容
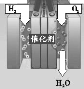
【题目】某烟气脱硫的工艺不仅能消除SO2,还能将其转化为石膏(CaSO42H2O)等产品,实现“变废为宝”。主要物质转化关系如下:

(1)设备1中,通过喷淋水脱去烟气中的SO2,该反应的化学方程式为_____。若将烟气中的SO2直接排放到空气中,可能会导致的污染问题是_____。
(2)设备2中,加入CaCO3的目的是将H2SO3转化为_____。
(3)设备3中,反应的化学方程式是_____,反应前后化合价发生改变的元素是_____。
(4)另一工厂为防治SO2的污染,另外设计了一种治污方法,不仅吸收了SO2,同时也得到了硫酸等化工产品,该工艺流程如图所示:

①Fe2(SO4)3吸收SO2的化学方程式是:Fe2(SO4)3 + 2_____+ SO2 = 2FeSO4 + 2H2SO4
②该流程中可循环利用的物质有_____。
【答案】SO2+H2O=H2SO3 形成酸雨 CaSO3 2CaSO3+O2=2CaSO4 S、O H2O H2SO4和FeSO4
【解析】
(1)二氧化硫和水反应生成亚硫酸,化学方程式为:SO2+H2O=H2SO3;二氧化硫在空气中易形成硫酸,将烟气中的SO2直接排放到空气中,可能会导致酸雨;
(2)碳酸钙和亚硫酸反应会生成亚硫酸钙、水和二氧化碳,所以设备2中,加入CaCO3的目的是将H2SO3转化为CaSO3;
(3)亚硫酸钙和氧气反应生成硫酸钙,化学方程式为:2CaSO3+O2=2CaSO4,钙元素在反应中始终为+2价,氧元素在化学反应中由-2价和0价转化为-2价,硫元素的化合价由+4价转化为+6价,反应中化合价发生改变的元素是硫(S)、氧(O);
(4)①根据“Fe2(SO4)3吸收SO2的化学方程式”可知,生成物质中2个铁原子,4个硫原子,16个氢原子,8个氧原子,反应物中2个铁原子,4个硫原子,14个氧原子,根据质量守恒定律,所以空格处是H2O;
②通过分析反应流程可知,硫酸、硫酸亚铁既是反应物,也是生成物,所以该流程中可循环利用的物质是H2SO4和FeSO4。

【题目】以下实验设计能达到目的的是( )
A | B | C | D |
|
|
|
|
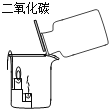
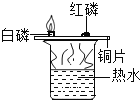
证明二氧化碳不可燃、不助燃、密度大于空气 | 测定空气中氧气的含量 | 证明可燃物燃烧需要氧气与温度达到着火点 | 证明铁生锈是水和氧气共同作用的结果 |
A.AB.BC.CD.D
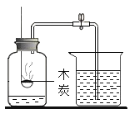
【题目】小红学碱的性质时做了如图两个实验,并把两个实验的滤液都倒入了一个烧杯中,结果烧杯中产生了少量气泡,最终还有白色沉淀生成。回答下列问题:

(1)实验①中酚酞溶液的作用___________________。
(2)实验②中滤液的溶质除有氢氧化钠外,还有________________(填化学式)。
(3)烧杯中产生白色沉淀物的化学方程式 ____________。
(4)小红对烧杯中的溶质的成分进行探究:小红认为除有NaCl外,还可能含有:
猜想1:还可能含有CaCl2
猜想2: 还可能含有___________,为了验证猜想1提出方案如下:
实验操作 | 实验现象 | 实验结论 |
取烧杯中的少量滤液于试管中,加入Na2CO3溶液 | _____________________ | 猜想1正确 |