题目内容
【题目】酸、碱、盐在生产和生活中应用广泛。
(1)下列物质露置于空气中一段时间后,会因变质而使溶液质量明显增加的是_(填字母代号)。
A 食盐水
B 浓硫酸
C 烧碱溶液
D 石灰水
(2)硫酸铵与熟石灰混合施用会降低肥效,有关反应的化学方程式为_。
(3)实验课上,小强将生锈铁钉放入稀盐酸中,观察到铁锈(主要成分是氧化铁)逐渐溶解,并有气泡产生,溶液由无色逐渐变为黄色,除去铁锈的化学方程式为_,请解释产生气泡的原因_。
(4)某同学为了除去NaCl溶液中的CaCl2、MgCl2、Na2SO4杂质制取精盐,设计如下实验流程:

①操作a和操作b都要用到的玻璃仪器是_。
②写出一个可使精盐中氯化钠质量增加的化学方程式_。
③固体B的成分是什么?__。
(5)取10g氯化钠溶液于烧杯中,加入足量的硝酸银溶液,充分反应后过滤,将滤渣洗涤烘干后得到2.87g固体,请计算该氯化钠溶液中溶质的质量 __ 。
【答案】C (NH4)2SO4+Ca(OH)2=CaSO4+2H2O+2NH3↑ Fe2O3+6HCl=2FeCl3+3H2O Fe+2HCl=FeCl2+H2↑ 玻璃棒 Na2CO3+2HCl═2NaCl+H2O+CO2↑ 硫酸钡、氢氧化镁、碳酸钙、碳酸钡 1.17g
【解析】
(1)下列物质露置于空气中一段时间后,会因变质而使溶液质量明显增加的是烧碱溶液,是因为氢氧化钠能和空气中的二氧化碳反应生成碳酸钠,变质后溶液质量增大。
故选:C。
(2)硫酸铵与熟石灰混合施用会降低肥效,是因为硫酸铵和氢氧化钙反应生成硫酸钙、水和氨气,有关反应的化学方程式为:(NH4)2SO4+Ca(OH)2=CaSO4+2H2O+2NH3↑。
(3)实验课上,小强将生锈铁钉放入稀盐酸中,观察到铁锈(主要成分是氧化铁)逐渐溶解,并有气泡产生,溶液由无色逐渐变为黄色,是因为氧化铁和盐酸反应生成氯化铁和水,除去铁锈的化学方程式为:Fe2O3+6HCl═2FeCl3+3H2O,产生气泡,是因为铁和盐酸反应生成氯化亚铁和氢气,反应的化学方程式:Fe+2HCl═FeCl2+H2↑。
(4)①操作a(过滤)和操作b(蒸发)都要用到的玻璃仪器是玻璃棒。
②碳酸钠能和盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式:Na2CO3+2HCl═2NaCl+H2O+CO2↑。
③固体B的成分是硫酸钡、氢氧化镁、碳酸钙、碳酸钡。
(5)解:设氯化钠质量为x,
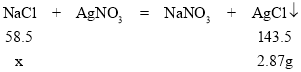
![]()
x=1.17g,
答:该氯化钠溶液中溶质的质量是1.17g。

【题目】请从 A 或B 两题中任选一个作答,若两题均作答,按 A 计分。
在一定条件下,Mg 和 MgH2的相互转化可以实现氢气的储存和释放。其工作原理如图。
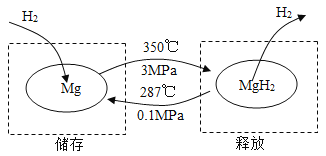
A | B |
(1)氢气储存时发生反应的化学方程式为_______。 (2)氢气很容易逃逸,若氢气存储效率为 10%,储存 1 kg 氢气,至少需要 Mg 的质量为_______ kg。 | (1)氢气释放时发生反应的化学方程式 为_______。 (2)理论上,52 kg MgH2最多能释放氢气的质量为_______ kg。 |