题目内容
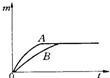
 23、用相同质量的铁和锌跟一定量的稀硫酸反应,其反应过程如下图所示(图中横、纵坐标分别表示反应的时间t和产生氢气的质量m).试回答:
23、用相同质量的铁和锌跟一定量的稀硫酸反应,其反应过程如下图所示(图中横、纵坐标分别表示反应的时间t和产生氢气的质量m).试回答:(1)曲线A表示
锌
(填“铁”或“锌”)跟稀硫酸反应的情况.(2)你得出上述结论的理由是
锌反应的速率比铁快
.分析:根据金属锌和铁的活动性锌>铁,判断反应过程图中曲线与金属的对应关系,并说明判断理由.
解答:解:(1)根据反应过程图可知,曲线A表示的金属的活动性比曲线B所示金属活动性强,则曲线A表示金属锌与稀硫酸反应;
故答案为:锌;
(2)相同时间内金属A产生的氢气大于金属B,即金属A的反应速率比较快;
故答案为:锌反应的速率比铁快.
故答案为:锌;
(2)相同时间内金属A产生的氢气大于金属B,即金属A的反应速率比较快;
故答案为:锌反应的速率比铁快.
点评:金属活动性越强,金属与酸反应越剧烈,相同时间内放出的气体越多,反应的速率越快.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 21、用相同质量的铁和锌跟一定量的稀硫酸反应,其反应过程如右图所示(图中横、纵坐标分别表示反应的时间t和产生氢气的质量m).试回答:
21、用相同质量的铁和锌跟一定量的稀硫酸反应,其反应过程如右图所示(图中横、纵坐标分别表示反应的时间t和产生氢气的质量m).试回答: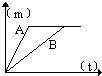 26、用相同质量的铁和锌跟一定量的稀硫酸反应,其反应过程如图所示(横坐标表示反应时间t,纵坐标表示产生H2的质量m).试回答:
26、用相同质量的铁和锌跟一定量的稀硫酸反应,其反应过程如图所示(横坐标表示反应时间t,纵坐标表示产生H2的质量m).试回答: ①曲线A表示的是
①曲线A表示的是
 化学兴趣小组同学对“金属活动性顺序”从内容、规律以及应用等方面进行了总结,请按要求填空:
化学兴趣小组同学对“金属活动性顺序”从内容、规律以及应用等方面进行了总结,请按要求填空: (2007?宣武区二模)初中化学课学完以后,化学学习兴趣小组对“金属活动性顺序”从内容、规律以及应用等方面进行了总结.请你认真填写下面的空白内容:
(2007?宣武区二模)初中化学课学完以后,化学学习兴趣小组对“金属活动性顺序”从内容、规律以及应用等方面进行了总结.请你认真填写下面的空白内容: