题目内容
【题目】将黑色粉末A、B混合装入试管中加强热,生成红色固体C,同时放出无色气体D。加热A并通入D时,只生成一种气体E。根据上述内容,回答下列问题:
(1)写出各物质的化学式:A______;B_______;C_______;D________;E________。
(2)写出A和B反应的化学方程式:__________________________________
【答案】 C CuO Cu CO2 CO C+ 2CuO![]() 2Cu+ CO2↑
2Cu+ CO2↑
【解析】黑色粉末有:四氧化三铁、碳粉、铁粉、二氧化锰、氧化铜;红色固体有:氧化铁、铜。将黑色粉末A、B混合装入试管中加强热,生成红色固体C,根据物质的转化关系可知是碳和氧化铜在高温时反应生成红色的铜和二氧化碳,即C是铜,D是二氧化碳。加热A并通入二氧化碳时,只生成一种气体E,碳能和二氧化碳反应生成一氧化碳,氧化铜不能和二氧化碳反应,故A是碳,B是氧化铜,那么E是一氧化碳。(1)A是碳:C,B是氧化铜:CuO,C是铜:Cu,D是二氧化碳:CO2,E是一氧化碳:CO ;(2)高温时,碳和氧化铜反应生成铜和二氧化碳,反应的化学方程式表示为C+ 2CuO![]() 2Cu+ CO2↑。
2Cu+ CO2↑。

【题目】下列除去杂质的方法正确的是
选项 | 物质 | 杂质 | 除杂方法 |
A | CaCl2溶液 | 稀盐酸 | 加过量碳酸钙,过滤 |
B | K2CO3溶液 | KCl | 加适量稀盐酸 |
C | CaO | CaCO3 | 加水,过滤 |
D | N2 | O2 | 通入灼热铜网 |
A. A B. B C. C D. D
【题目】在学习盐酸的化学性质时,小红、芳芳两位同学分别作了碳酸钠溶液和稀盐酸反应的实验如图所示。
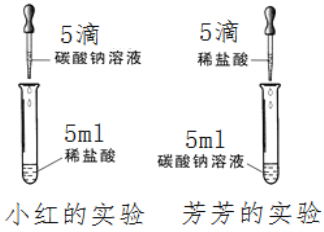
【实验现象】小红在实验中观察到有气泡冒出,而芳芳
所做的实验无现象。写出小红实验的化学反应方程式:________________。
【实验讨论】芳芳同学的试验为什么观察不到有气泡?
反应后溶液的溶质有哪些?
【查阅资料】①碳酸钠和稀盐酸反应生成物受到盐酸的质
量影响,稀盐酸过量生成二氧化碳,若盐酸量不足则生成碳酸氢钠;②碳酸氢钠与氯化钙溶液混合不发生反应,而碳酸钠和氯化钙溶液反应生成沉淀,且碳酸钠和碳酸氢钠溶液都呈碱性,氯化钙溶液呈中性。
【猜想与假设】实验反应后溶液中溶质可能有:①NaHCO3、NaCl、Na2CO3; ②NaHCO3、NaCl;
③NaHCO3、NaCl、HCl。
芳芳同学认为猜想③肯定不成立,理由是______________。
【实验设计】确定芳芳同学实验是否生成碳酸氢钠,并证明反应后的产物。
实验步骤 | 实验现象 | 实验结论 |
A、取上述溶液少量于试管中,加 入足量的________溶液。 | 产生白色沉淀 | 猜想①正确 |
B、取步骤A所得上层清液少量,滴加_______溶液。 | ___________ |
【实验反思】若用少量的稀盐酸鉴定氢氧化钠是否变质,发现无气泡冒出,则证明氢氧化钠溶液没有变质。对此实验结论,你是否赞同?若不赞同,还需说明理由。_____________。