题目内容
【题目】某硫酸钠样品中含有少量氯化钠.取15g该样品于烧杯中,加入50g水后完全溶解.向烧杯中滴加208.3g氯化钡溶液,恰好完全反应,过滤、干燥,称得固体物质的质量为23.3g.请计算 已知:BaCl2+Na2SO4=BaSO4↓+2NaCl
(1)硫酸钠样品中氯化钠的质量
(2)若将滤液的溶质质量分数变为10%,需蒸发掉水的质量.
【答案】
(1)解:设:样品中硫酸钠的质量为x,生成氯化钠的质量为y.
BaCl2+ | Na2SO4═ | BaSO4↓+ | 2NaCl |
142 | 233 | 117 | |
x | 23.3g | y |
![]()
x=14.2 g y=11.7 g
样品中氯化钠的质量=15g﹣14.2g=0.8g
答:样品中氯化钠的质量为0.8g.
(2)解:设蒸发水的质量为m.
![]() =10%
=10%
解得m=125g
答:若将滤液的溶质质量分数变为10%,需蒸发掉水的质量为125g.
【解析】解:设:样品中硫酸钠的质量为x,生成氯化钠的质量为y.
BaCl2+ | Na2SO4═ | BaSO4↓+ | 2NaCl |
142 | 233 | 117 | |
x | 23.3g | y |
![]()
x=14.2 g y=11.7 g
样品中氯化钠的质量=15g﹣14.2g=0.8g(2)根据溶质的质量分数= ![]() .溶质的质量为反应生成的氯化钠和原来样品中的氯化钠质量之和.溶液的质量为样品的质量加上溶解它的水的质量加上氯化钡溶液的质量,然后减去生成的沉淀的质量和减去蒸发掉的水的质量.
.溶质的质量为反应生成的氯化钠和原来样品中的氯化钠质量之和.溶液的质量为样品的质量加上溶解它的水的质量加上氯化钡溶液的质量,然后减去生成的沉淀的质量和减去蒸发掉的水的质量.
【考点精析】关于本题考查的根据化学反应方程式的计算,需要了解各物质间质量比=系数×相对分子质量之比才能得出正确答案.

 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
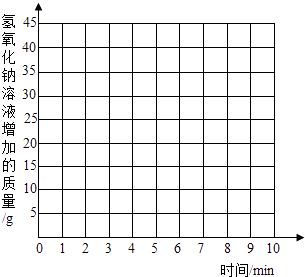
名校名师培优作业本加核心试卷系列答案【题目】热水瓶胆水垢的主要成分是Mg(OH)2和CaCO3 , 可用适量盐酸清洗除去.小红为测定水垢中碳酸钙的质量分数,进行了如下实验:取200g水垢,往其中逐滴加入足量的稀盐酸,将产生的气体缓缓通入足量氢氧化钠溶液中,同时测量8min内氢氧化钠溶液质量的变化值.所得结果如下表所示(忽略稀盐酸的挥发).
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
氢氧化钠溶液增加的质量(g) | 0 | 13 | 24 | 32 | 31 | 41 | 43 | 44 | 44 |
(1)表中有一个时间测量的“氢氧化钠溶液增加的质量”数据是错误的,此时间是第min;
(2)200g水垢溶于足量稀盐酸中,产生CO2的最大质量为g;
(3)计算水垢中碳酸钙的质量分数.
(4)请在如图坐标图中用正确的数据描绘出氢氧化钠溶液增加的质量与时间的变化关系图.