题目内容
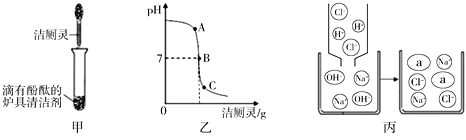
【题目】实验室有失落标签的4瓶无色溶液:MgCl2、NaCl、HCl、NaOH,现实验桌上只有1瓶酚酞试液。请你设计只用瓶酚酞试液鉴别上述溶液的实验方案。
实验设计方案 | |
实验步骤 | 预计产生的实验现象和由此得出的结论 |
(1) | |
(2) | |
【答案】
【解析】因为酚酞遇氢氧化钠溶液变红色,所以首先取样品滴加酚酞,变红的是氢氧化钠溶液,氢氧化钠溶液与氯化镁溶液有白色沉淀产生,而盐酸可以和氢氧化钠溶液发生中和反应,加入过量盐酸时溶液由碱性变成酸性,使酚酞试液由红色变成无色。故答案为:
方案一:
实验设计方案 | |
实验步骤 | 预计产生的实验现象和由此得出的结论 |
(1)分别取样,滴加酚酞试液 | 变红的是氢氧化钠溶液 |
(2)分别取其他三种未知溶液的样品,滴入NaOH溶液 | 产生白色沉淀的原溶液是MgCl2 |
(3)取少量的NaOH溶液,滴入几滴酚酞后一分为二,分别加入较多的另两种溶液 | 溶液红色褪去的是HCl溶液,不褪色的是NaCl溶液 |
方案二:
实验设计方案 | |
实验步骤 | 预计产生的实验现象和由此得出的结论 |
(1)分别取样,滴加酚酞试液 | 溶液变红色的为氢氧化钠溶液 |
(2)取上述滴有酚酞的NaOH溶液,分成三份,分别加入较多的另两种溶液 | 产生白色沉淀的原溶液是MgCl2,红色褪去的原溶液是HCl,没有明显变化的原溶液是NaCl |

练习册系列答案
相关题目