题目内容
24、某物质的化学式为H2b-mXOb,则元素X的化合价为( )
分析:根据在化合物中正负化合价代数和为零进行分析解答本题.
解答:解:根据在化合物中正负化合价代数和为零,H2b-mXOb中元素X的化合价为:(+1)×(2b-m)+x+(-2)×b=0,
则x=m,故选C.
则x=m,故选C.
点评:本题考查学生根据在化合物中正负化合价代数和进行分析解题的能力,属于基础知识和基本技能.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
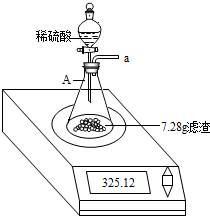 一化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.
一化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.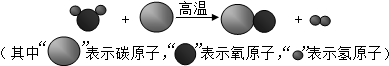 (1)该反应生成物的化学式为
(1)该反应生成物的化学式为 与
与 两物质的质量比是
两物质的质量比是