题目内容
【题目】没有水就没有地球上的生命,人类的日常生活离不开水。
(1)日常生活中常用的净化水的操作有沉淀、过滤、吸附、蒸馏等,其中能把硬水软化的操作是_________。
(2)写出电解水的化学反应方程式:___________;该反应的基本类型是_____。
(3)A、B、C三种固体的溶解度曲线如图所示:①P点的含义是______________;②t1℃时,将10gA物质加入50g水中,充分溶解后,形成溶液的质量为____ g;
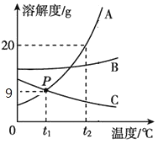
③t2℃时,将A、B、C物质饱和溶液各100克,分别蒸发10克水后,剩余溶液质量分数由大到小的顺序是________。
(4)氢氧化钠是实验室中常见的碱,现用氢氧化钠固体配制溶质质量分数为40%(密度为1.43g/mL)氢氧化钠溶液100mL,过程如下:
①计算:需称量氧氢化钠固体__________ g,加水体积为___________mL。
②称量:如图称量氢氧化钠固体的操作中,有一处明显错误是________________________。
③溶解:将正确操作称量好的氢氧化钠固体加入烧杯中,并将量取的蒸馏水倒入烧杯中,并用玻璃棒搅拌,使它完全溶解。经检测,所配制溶液的溶质质量分数偏小,其原因可能是_________(填序号)。

①氢氧化钠固体不纯 ②量取水时,俯视读数
③量取水时,仰视读数 ④装瓶时,有少量溶液洒出
【答案】蒸馏 2H2O ![]() 2H2↑+O2↑ 分解反应 t1℃时,A物质和C物质的溶解度相等都为9克 54.5 A>B>C 57.2 85.8 氢氧化钠是腐蚀性药品,没有放在玻璃器皿中称量。 ①③
2H2↑+O2↑ 分解反应 t1℃时,A物质和C物质的溶解度相等都为9克 54.5 A>B>C 57.2 85.8 氢氧化钠是腐蚀性药品,没有放在玻璃器皿中称量。 ①③
【解析】
(1)日常生活中常用的净化水的操作有沉淀、过滤、吸附、蒸馏等,其中能把硬水软化的操作是蒸馏,故填:蒸馏;
(2)水通电生成氢气和氧气,反应的化学方程式为2H2O ![]() 2H2↑+O2↑,该反应符合分解反应一变多的特征,故填:2H2O
2H2↑+O2↑,该反应符合分解反应一变多的特征,故填:2H2O ![]() 2H2↑+O2↑;分解反应;
2H2↑+O2↑;分解反应;
(3)①溶解度曲线的交点表示物质的溶解度相同,P点的含义是t1℃时,A物质和C物质的溶解度相等都为9克;
②t1℃时,物质A的溶解度为9g,即100g水最多能溶解9gA,将10gA物质加入50g水中,充分溶解后,形成溶液的质量为50g+4.5g=54.5 g;
③t2℃时,将A、B、C饱和溶液的质量分数大小A>B>C,分别蒸发10克水后,剩余溶液质量分数不变,由大到小的顺序是A>B>C;
(4)①计算:需称量氧氢化钠固体的质量为100ml×1.43g/mL×40%=57.2g,加水质量为100ml×1.43g/mL-57.2g =85.8g,故水的体积为85.8mL,故填:57.2;85.8;
②称量:如图称量氢氧化钠固体的操作中,有一处明显错误是氢氧化钠是腐蚀性药品,没有放在玻璃器皿中称量,故填:氢氧化钠是腐蚀性药品,没有放在玻璃器皿中称量;
③:
①根据溶液的溶质的质量分数=![]() ,氯化钠固体不纯,即溶质的质量偏小,会导致溶液的质量分数偏小,正确;
,氯化钠固体不纯,即溶质的质量偏小,会导致溶液的质量分数偏小,正确;
②量取水时,俯视读数,量取水的体积偏小,导致溶液的质量分数偏大,错误;
③量取水时,仰视读数,量取水的体积偏大,导致溶液的质量分数偏小,正确;
④溶液具有均一性,装瓶时,有少量溶液洒出,对溶液质量分数无影响,错误;
故选①③。