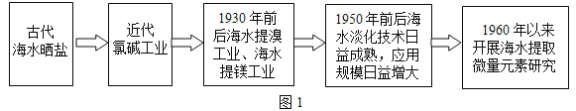
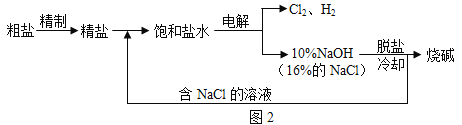
��Ŀ����
����Ŀ��ij��ɫ������ܺ���H2��CO��CH4�е�һ�ֻ��֣����ν�������ʵ��(����ÿһ����Ӧ�����վ���ȫ)������ɫ�����������г��ȼ�գ���ȼ�պ����ɵ�����ͨ��ʢŨ�����װ�ã�װ�õ���������12.6g�����ٽ�ʣ������ͨ��ʢNaOH��Һ��װ�ã�װ�õ���������13.2g�������ƶ���ȷ����
A. �����岻����ֻ��H2��CO B. ���������ֻ��H2��CH4
C. ���������ֻ��CO��CH4 D. ���������ֻ��CH4
���𰸡�B
��������
�����ɵ�����ͨ��Ũ���ᣬװ����������12.6g�����ж�ȼ��������12.6ˮ��˵����������к���Ԫ�أ�����Ԫ������=12.6g��![]() ��100%=1.4g��������ͨ������������Һ��װ����������13.2g�����ж�ȼ��������13.2g������̼��˵����������к�̼Ԫ�أ���̼Ԫ������=13.2g��
��100%=1.4g��������ͨ������������Һ��װ����������13.2g�����ж�ȼ��������13.2g������̼��˵����������к�̼Ԫ�أ���̼Ԫ������=13.2g��![]() ��100%=3.6g������������C��HԪ��������=12����1��4��=3��1������������C��HԪ��������=3.6g��1.4g=18��7С��3��1����˿��жϻ����������Ǽ������������顢������һ����̼ͬʱ���ڣ��۲�ѡ�ֻ��B��˵����ȷ����ѡD��
��100%=3.6g������������C��HԪ��������=12����1��4��=3��1������������C��HԪ��������=3.6g��1.4g=18��7С��3��1����˿��жϻ����������Ǽ������������顢������һ����̼ͬʱ���ڣ��۲�ѡ�ֻ��B��˵����ȷ����ѡD��

��ϰ��ϵ�д�
�����Ŀ