题目内容
【题目】金属材料在生产、生活中有广泛的应用,人类的生产和生活都离不开金属。
(一)铁的应用和防护
(1)钢铁的锈蚀主要是铁与空气中的_____等物质发生化学反应的结果。
(2)为防止铁生锈,通常会对铁制品进行“烤蓝”处理,烤蓝是用化学方法在铁表面生成层致密的四氧化三铁(Fe3O4)保护膜。烤蓝的原理是:在高温下,铁与水发生反应, 生成四氧化三铁和一种单质气体,写出该反应的化学反应方程式:_____。
(二)铁的冶炼
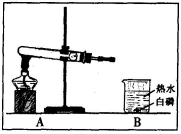
我国劳动人民在春秋战国时期就会治铁炼钢,实验室模拟炼铁实验装置如图所示。
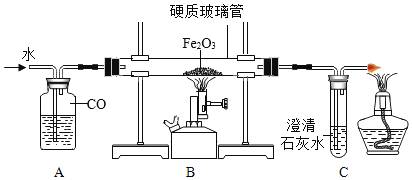
(3)实验时,应先注水片刻后再加热的目的是_____。
(4)有同学提出黑色粉末中还可能含有 Fe3O4.已知:Fe3O4 能溶于稀 H2SO4,且有 Fe3+ 生成;Fe3+遇到硫氯化钾溶液显血红色。为证明黑色粉末成份,该同学取少量样品于烧杯中,加过量稀 H2SO4,充分反应后,滴加少量硫氰化钾,证明黑色粉末中含有 Fe 和Fe3O4 的现象是_____。
(5)若取 16g 氧化铁粉末进行实验,反应一段时间后,经检测剩余黑色固体成份是 Fe和 Fe3O4,称量固体的质量为 X,则 X 的范围为_____。
【答案】氧气、水 3Fe+4H2O![]() Fe3O4+4H2 排尽装置内的空气,防止加热时发生爆炸 溶液中有气泡产生,且溶液变为血红色 11.2g<X<15.5g
Fe3O4+4H2 排尽装置内的空气,防止加热时发生爆炸 溶液中有气泡产生,且溶液变为血红色 11.2g<X<15.5g
【解析】
(一)(1)钢铁的锈蚀主要是铁与空气中的氧气、水等物质发生化学反应的结果;
(2)烤蓝的原理是:在高温下,铁与水发生反应, 生成四氧化三铁和一种单质气体,根据质量守恒定律可知,气体单质为氢气,反应的化学反应方程式:3Fe+4H2O![]() Fe3O4+4H2;
Fe3O4+4H2;
(二)(3)实验时,应先注水,片刻后再加热的目的是排尽装置内的空气,防止加热时发生爆炸;
(4)黑色固体含有铁和四氧化三铁,那铁与硫酸反应生成氢气,会有气泡出现,Fe3O4能溶于稀H2SO4,且有Fe3+生成,Fe3+遇到硫氰化钾显示血红色,所以通过观察上述两种现象,即可判断含有铁和四氧化三铁;
(5)根据质量守恒定律,若氧化铁全部生成铁,则铁全部来自于氧化铁,所以铁的质量=氧化铁中铁元素质量= ![]() =11.2g,若氧化铁全部生成了四氧化三铁,设四氧化三铁的质量为m,则四氧化三铁中铁元素质量=氧化铁中铁元素质量,设四氧化三铁的质量为m,则m×
=11.2g,若氧化铁全部生成了四氧化三铁,设四氧化三铁的质量为m,则四氧化三铁中铁元素质量=氧化铁中铁元素质量,设四氧化三铁的质量为m,则m×![]() ,所以X在11.2g与15.5g之间即可。
,所以X在11.2g与15.5g之间即可。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案