题目内容
【题目】(1)将质量为mg的锌粉放入硝酸亚铁、硝酸银的混合溶液中,恰好完全反应后过滤,将滤渣洗涤烘干后称量,发现滤渣质量仍为mg·则滤渣中银和铁的质量比_____;
(2)现有40℃硝酸钾的饱和溶液82g,当温度降到10℃时,溶液质量变为60.5g,此时,需再加102.4g水才能将晶体恰好全部溶解完,则40℃时硝酸钾的溶解度为_____。
【答案】243:1057 64g
【解析】
(1)设反应生成的银质量为x,锌与硝酸银反应后固体增加质量为y。
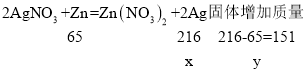
![]()
设反应生成的铁质量为a,锌与硝酸亚铁反应后固体减少质量为b。
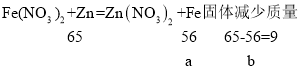
![]()
根据题意可知,反应前后固体的质量不变,都是m,则反应过程中固体增加的质量与减少的质量相等,所以:![]() ;
;
(2)根据题意,当温度下降至10℃时析出硝酸钾的质量为82.0g-60.5g=21.5g,此时,需再加102.4g水才能将晶体恰好全部溶解完,说明21.5g硝酸钾与102.4g水恰好形成饱和溶液,10℃时硝酸钾饱和溶液的溶质质量分数=![]() ,则10℃时溶液质量为60.5g的硝酸钾饱和溶液中所含硝酸钾的质量=60.5g×17.35%=10.5g。40℃时KNO3的饱和溶液82.0g中所含硝酸钾的质量=10.5g+21.5g=32g则40℃时KNO3的溶解度=
,则10℃时溶液质量为60.5g的硝酸钾饱和溶液中所含硝酸钾的质量=60.5g×17.35%=10.5g。40℃时KNO3的饱和溶液82.0g中所含硝酸钾的质量=10.5g+21.5g=32g则40℃时KNO3的溶解度=![]() 。
。

练习册系列答案
 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
【题目】在不同时刻,某反应中的甲、乙、丙、丁四种物质的质量如下表。已知甲的相对分子质量为丁的2倍。则下列说法不正确的是( )
甲的质量/g | 乙的质量/g | 丙的质量/g | 丁的质量/g | |
反应前 | 64 | 10 | 1 | 16 |
t时刻 | 32 | 26 | b | c |
反应后 | 16 | a | 1 | d |
A.a等于34,c等于32
B.甲是反应物,乙和丁是生成物,此反应的基本类型是分解反应
C.丙可能是催化剂
D.该反应方程式中甲与丁的化学计量数之比为![]()