题目内容
【题目】用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验。已知:白磷的着火点为40℃,实验时打开导管中的开关。
步骤 | (实验1)研究燃烧条件 | (实验2)研究氧气性质 |
Ⅰ | 烧杯中盛有80℃的热水,分别在燃烧匙和烧杯中导管口放置一小块白磷,塞紧瓶塞 | 烧杯中盛有NaOH溶液,燃烧匙中放入木炭,点燃木炭后迅速将燃烧匙伸入瓶中,塞紧瓶塞 |
Ⅱ | 推入适量H2O2溶液 | 推入适量H2O2溶液 |
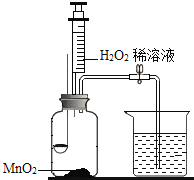
(1)实验1中,推入H2O2溶液前,燃烧匙和水中的白磷均不燃烧,燃烧匙中白磷不燃烧的原因是_____; 烧杯中白磷未燃烧的原因是_____; 推入H2O2溶液后,观察到烧杯中的现象是_____。
(2)实验2中,推入H2O2溶液后,观察到木炭燃烧得更剧烈,由此得出氧气的性质是_____;木炭熄灭后冷却一段时间,烧杯中的溶液_____(填“能”或“否”)流入集气瓶。
【答案】温度未达到白磷的着火点 白磷没有与O2接触 导管口有气泡冒出,烧杯中的白磷燃烧 助燃 能
【解析】
(1)燃烧匙中的白磷与空气接触,但是处于常温下,根据燃烧的条件可知,燃烧匙中白磷不燃烧是因为温度未达到白磷的着火点;烧杯中白磷处于80℃热水中,但是与氧气不接触,故烧杯中白磷未燃烧是因为没有与O2接触;推入H2O2溶液后,生成氧气,氧气通过导管进入烧杯,所以烧杯中的导管口有气泡冒出,烧杯中的白磷温度达到了着火点,与氧气接触,故烧杯中的白磷燃烧,故填:温度未达到白磷的着火点,白磷没有与氧气接触,导管口有气泡冒出,烧杯中的白磷燃烧;
(3)实验2中,推入H2O2溶液后,过氧化氢在二氧化锰的催化下产生氧气,观察到木炭燃烧得更剧烈,由此得出氧气的性质是助燃性;
题目指明:实验时打开导管中的开关。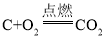 ,碳燃烧放出热量,装置内气体膨胀,压强增大,生成二氧化碳被氢氧化钠溶液吸收,木炭熄灭后冷却一段时间后,装置中压强小于外界压强,所以木炭熄灭后冷却一段时间,烧杯中的部分溶液能流入集气瓶。
,碳燃烧放出热量,装置内气体膨胀,压强增大,生成二氧化碳被氢氧化钠溶液吸收,木炭熄灭后冷却一段时间后,装置中压强小于外界压强,所以木炭熄灭后冷却一段时间,烧杯中的部分溶液能流入集气瓶。
故答案为:
(1)未达到白磷的着火点;白磷没有与O2接触;导管口有气泡冒出,烧杯中的白磷燃烧;(2)助燃;能

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案【题目】(9分)某学习小组的同学做实验,向盛有少量氢氧化钠溶液的试管中通入二氧化碳,未看到明显的实验现象。
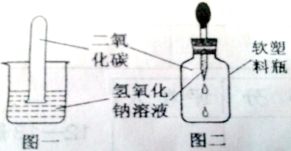
【提出问题】氢氧化钠能否与二氧化碳反应?
【猜想与假设】亮亮同学认为氢氧化钠能与二氧化碳反应;莉莉同学认为氢氧化钠不能与二氧化碳反应。
【设计与实验】亮亮同学设计了两个装置并进行实验。请你和他一起验证他的猜想。
实验步骤 | 实验现象 | 实验结论 |
如图一,将收集满二氧化碳的试管倒置于氢氧化钠溶液中 | ||
如图二, |
【反思与评价】莉莉同学提出质疑,认为上述现象可能是二氧化碳溶于水的结果。
【设计与实验】请你设计一个实验,证明氢氧化钠确实与二氧化碳反应。
实验步骤 | 实验现象 | 实验结论 |
氢氧化钠与二氧化碳反应 |
【交流与提高】实验证明氢氧化钠还能与二氧化硫反应,化学方程式为:
2NaOH+SO2=X+H2O,X的化学式是 。
【题目】NaNO3和KNO3的溶解度表及溶解度曲线如下。下列说法正确的是( )
温度/℃ | 20 | 30 | 50 | 60 | 80 | |
溶解度S/g | NaNO3 | 87.6 | 94.9 | 110 | 122 | 148 |
KNO3 | 31.6 | 45.3 | 85.5 | 110 | 167 | |
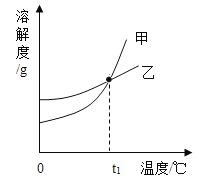
A.甲表示NaNO3溶解度曲线
B.40 ℃时,饱和溶液的溶质质量分数KNO3>NaNO3
C.t1应介于60 ℃~80 ℃
D.80 ℃时,KNO3饱和溶液中含有少量NaNO3,要得到较纯净的KNO3晶体,可采用蒸发结晶、过滤等操作
【题目】小华有一只银手镯(银锌合金),她想用实验探究手镯中银的含量。先用电子秤称得手镯的质量是25.00克,再用稀盐酸分多次与此手镯充分反应。实验数据如下表:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入烯盐酸的质量(克) | 10.00 | 10.00 | 10.00 | 10.00 | 10.00 |
充分反应后剩余固体的质量(克) | 24.35 | 23.70 | 23.05 | 23.00 | 23.00 |
根据上表中数据分析,完成下列问题:
(1)手镯中银的质量是________克。
(2)所用稀盐酸中溶质的质量分数是多少________?