题目内容
【题目】氯化钠是一种重要的资源,在海水中储量很丰富。回答问题:
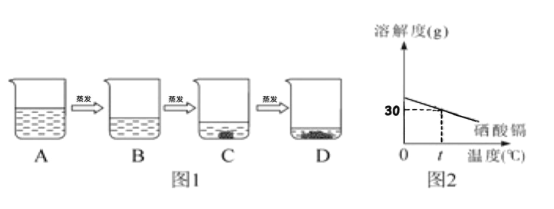
(1)海水晒盐是海水在常温下蒸发得到氯化钠的过程, 用氯化钠溶液模拟该过程 (如图1所示)。已知B溶液恰好是氯化钠的饱和溶液,与B溶液中溶质质量相等的溶液是___(填字母序号,下同),与B溶液中溶质的质量分数相等的溶液是___.
(2)图2为硒酸镉的溶解度曲线。t ℃时,将15g硒酸镉加入____g水中,完全溶解后,恰好得到饱和溶液。要进一步提高硒酸镉溶液中溶质的质量分数,进行的操作是_________ 。
【答案】A CD 50 降温并加入硒酸镉
【解析】
(1)由海水晒盐的过程可知,A的溶液通过蒸发溶剂形成了B的溶液,B溶液恰好是氯化钠的饱和溶液,A、B溶液中溶质质量相等;C、D的溶液都是常温下氯化钠的饱和溶液,与B溶液中溶质质量分数相等;
(2)由硒酸镉的溶解度曲线可知,在t℃时硒酸镉的溶解度是30g,在t℃时将15g硒酸镉加入50g水中,完全溶解后,得到饱和溶液;由于硒酸镉的溶解度随温度的升高而减小,要进一步提高该溶液的溶质质量分数,可进行的操作是降低温度后再加入硒酸镉。

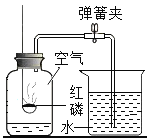
【题目】某化学小组为验证稀硫酸的性质,并探究反应后废液的成分,进行了如下实验。
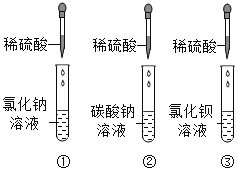
I:验证稀硫酸的某些性质
(1)按图所示进行实验,其中试管_____(选填序号)中无明显现象,小组同学讨论认为该试管中的两种物质间没有发生复分解反应,他们的理由是_____。
(2)为验证稀硫酸和氢氧化钠溶液是否发生反应,小明和小红分别向盛有氢氧化钠溶液的试管中,先加稀硫酸,再向混合后的溶液中滴加几滴酚酞溶液,结果小明观察到溶液为红色。小红观察到溶液为无色,于是二者得出了不同的结论。
小组同学在不改变所用试剂的情况下。对他们的实验方案进行了修改,从而确保实验一定能得出“硫酸与氢氧化钠溶液发生了化学反应”的结论。他们的实验方案是(只写操作过程):_____。
Ⅱ:探究反应后废液的成分
将如图所示实验后三支试管中的物质均倒入同一烧杯中,充分混合后静置,得到白色沉淀和无色溶液,用pH计测得无色溶液的pH=8.6。
(提出问题)无色溶液中溶质的成分是什么?
(作出猜想)猜想一:Na2CO3和NaCl;猜想二:H2SO4和Na2SO4;
猜想三:NaCl和Na2SO4;猜想四:Na2CO3、NaC1和Na2SO4
小组讨论认为猜想二不合理,理由是_____。
(进行实验)
实验步骤 | 实验操作 | 实验现象 | 实验结论 |
① | 取少量无色溶液于试管中。向其中滴加稀盐酸 | _____ | 猜想三不成立 |
② | 向步骤①后的溶液中加入BaCl2溶液。 | 产生白色沉淀 | 猜想四成立 |
小组同学认为“猜想四成立”这一结论是不可靠的,理由是_____。(用化学方程式表示)。
小组同学在不改变所用试剂的情况下,对实验方案进行了修改,并重新进行了实验,仍然得出“猜想四成立”的结论。他们修改后的实验方案是_____。
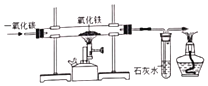
【题目】某化学探究小组以“寻找过氧化氢分解新的催化剂”为课题,开展了下列实验。
(提出问题)氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?
(猜想与假设)_____。
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
Ⅰ.分别量取5mL 5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入a g氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生较多气泡,带火星木条_____,B试管中无明显现象 | ①A试管产生的气体是_____(填化学式)氧化铁可加快过氧化氢的分解速率 |
Ⅱ.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | 试管中均产生气泡,带火星木条均复燃 | 氧化铁的_____在反应前后均没有发生变化。 |
Ⅲ.将实验II中的剩余物________(填操作名称),并将所得滤渣进行洗涤、干燥、称量 | 所得固体质量仍为a g | 氧化铁的_____在反应前后均没有发生变化。 |
(实验结论)
(1)实验II、III得出结论:_____。
(2)请写出氧化铁催化过氧化氢溶液分解的化学方程式_____。
(实验拓展)
(3)查阅资料得知,CuO、CuSO4、猪肝、马铃薯等也可以做过氧化氢溶液分解的催化剂。下列有关催化剂的说法中正确的是_____。
A MnO2只能作过氧化氢溶液分解的催化剂
B 同一个化学反应可以有多种催化剂
C 催化剂只能加快化学反应的速率
D 用作催化剂的物质不可能是其他反应的反应物或生成物。