题目内容
在杠杆的两端分别挂着一个质量相同的锌球,这时杠杆平衡.然后将两球分别浸没在稀H2SO4和CuSO4溶液中片刻,下列说法中正确的是( )
A.只有左边烧杯中溶液的质量增加
B.只有右边烧杯中溶液的质量增加
C.两边烧杯中的溶液质量都增加
D.取掉烧杯后,杠杆不再保持平衡
【答案】分析:在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.
解答:解:锌与硫酸反应生成硫酸锌和氢气,
Zn+H2SO4═ZnSO4+H2↑△m
65 2 63
△m为正值,故溶液质量增加,金属锌的质量减小,
锌与硫酸铜反应生成硫酸锌和铜,
Zn+CuSO4═ZnSO4+Cu△m
65 64 1
△m为正值,故溶液质量增加,金属锌的质量减小,
A、只有左边烧杯中溶液的质量增加,故错误;
B、只有右边烧杯中溶液的质量增加,故错误;
C、两边烧杯中溶液的质量都增加,故正确;
D、锌和硫酸反应质量会明显减小;锌和硫酸铜反应,铜会覆盖在锌的表面,质量减小不明显,因此取掉烧杯后,杠杆不再保持平衡.故D说法正确;
故选CD.
点评:本题考查了金属活动性顺序的应用,可以依据金属活动性顺序及其意义和差量法进行分析解答.
解答:解:锌与硫酸反应生成硫酸锌和氢气,
Zn+H2SO4═ZnSO4+H2↑△m
65 2 63
△m为正值,故溶液质量增加,金属锌的质量减小,
锌与硫酸铜反应生成硫酸锌和铜,
Zn+CuSO4═ZnSO4+Cu△m
65 64 1
△m为正值,故溶液质量增加,金属锌的质量减小,
A、只有左边烧杯中溶液的质量增加,故错误;
B、只有右边烧杯中溶液的质量增加,故错误;
C、两边烧杯中溶液的质量都增加,故正确;
D、锌和硫酸反应质量会明显减小;锌和硫酸铜反应,铜会覆盖在锌的表面,质量减小不明显,因此取掉烧杯后,杠杆不再保持平衡.故D说法正确;
故选CD.
点评:本题考查了金属活动性顺序的应用,可以依据金属活动性顺序及其意义和差量法进行分析解答.

练习册系列答案
相关题目
在杠杆的两端分别挂着质量和体积都相同的铁球和铝球,这时杠杆平衡.将两球分别浸泡在质量相同,浓度相同的稀硫酸中(如图),直至两个烧杯中均没有气泡产生为止.两球的外形变化不大且无孔洞出现.下列推测中正确的是( )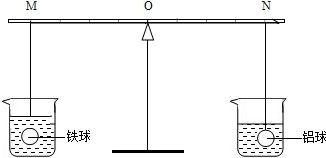

| A、拿掉烧杯后,要使杠杆仍然平衡,支点应向M移动 | B、铁球一定是空心的 | C、拿掉烧杯后,杠杆仍然平衡(金属球上附着的液体忽略不计,下同) | D、拿掉烧杯后,要使杠杆仍然平衡,支点应向N移动 |

 15、如图所示,在杠杆的两端分别挂着质量相同的铜球和锌球,这时杠杆平衡.然后将两球分别浸没在稀H2SO4和CuSO4溶液中一段时间.
15、如图所示,在杠杆的两端分别挂着质量相同的铜球和锌球,这时杠杆平衡.然后将两球分别浸没在稀H2SO4和CuSO4溶液中一段时间. 10、在杠杆的两端分别挂着等质量等体积的铁球和铝球,这时杠杆平衡,将两球分别浸泡在两份完全相同的稀硫酸中,直至两个烧杯中均无气泡产生为止,两球的形状变化不大,且无空洞出现,根据实验现象推测:
10、在杠杆的两端分别挂着等质量等体积的铁球和铝球,这时杠杆平衡,将两球分别浸泡在两份完全相同的稀硫酸中,直至两个烧杯中均无气泡产生为止,两球的形状变化不大,且无空洞出现,根据实验现象推测: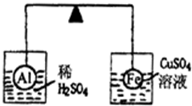 如图所示,在杠杆的两端分别挂着质量和体积都相同的铝球和铁球,这时杠杆平衡,然后将两个球分别浸没在稀硫酸和硫酸铜溶液中片刻,下列说法中正确的是( )
如图所示,在杠杆的两端分别挂着质量和体积都相同的铝球和铁球,这时杠杆平衡,然后将两个球分别浸没在稀硫酸和硫酸铜溶液中片刻,下列说法中正确的是( )