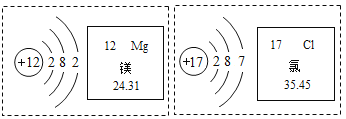
题目内容
【题目】海水中蕴藏着丰富的资源,海水“晒盐过程中可得到粗盐和卤水。粗盐中常含有多种杂质,必须对其进行分离和提纯,才能用于生产和生活;卤水经常用作工业制镁的原料。
(1)实验室除去粗盐中不溶性杂质的步骤为:溶解、过滤、蒸发结晶。在三步中都要用到的一种玻璃仪器是____。
(2)若要除去食盐固体中含有的少量CaCl2杂质,得到较为纯净的食盐固体,实验操作步骤为:将食盐固体放入烧杯中,加入足量水溶解,然后向烧杯中先加入过量的____(填化学式)溶液,过滤,再向滤液中加入适量的____(填化学式),最终蒸发结晶。(填化学式)
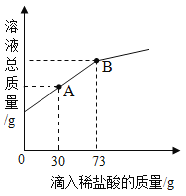
(3)在一烧杯中盛有Mg(OH)2和MgCl2的固体粉末6g,向其中加入20g水,经充分溶解后,再逐滴加入溶质质量分数为10%的稀盐酸。烧杯中溶质的总质量与加入稀盐酸的质量关系如图所示。请回答下列问题。
①当滴入稀盐酸30g时(即图中A点时),烧杯内溶液中的溶质是____(填写化学式)。
②当滴入稀盐酸73g时(即图中B点时),试通过计算,求此温度时所得不饱和溶液中溶质的质量___(计算结果精确至0.1g)。
【答案】玻璃棒 Na2CO3 HCl MgCl2 9.7g
【解析】
(1)溶解、过滤、蒸发结晶都需要用到玻璃棒,作用各不同,溶解中玻璃棒的作用是加速溶解,过滤中玻璃棒的作用是引流,蒸发结晶过程中玻璃棒的作用是使受热均匀;故填:玻璃棒。
(2)除去氯化钠中的氯化钙,首先要加入碳酸钠,为彻底去除氯化钙,加入的碳酸钠要过量,然后过滤后,得到氯化钠和碳酸钠的混合溶液,加过量的盐酸将碳酸钠去除,而稀盐酸的过量可以通过蒸发去除.所以操作为:取样品于烧杯中,充分溶解,向烧杯中加入足量的碳酸钠,震荡,过滤,向滤液中加入足量的稀盐酸,蒸发结晶;故填:Na2CO3;HCl。
(3)通过图可以看出,加入盐酸到73g 时恰好完全反应,所以加入盐酸30g时,此时的溶质为氯化镁,对应的化学式为MgCl2.尚有剩余的氢氧化镁没有反应.
加入73g稀盐酸时,加入的HCl的质量为73g×10%=7.3g
设氢氧化镁的质量为x,生成的氯化镁的质量为y

x=5.8g
y=9.5g
所得溶液中氯化镁的质量为6g-5.8g+9.5g=9.7g
答:所得不饱和溶液中溶质的质量为9.7g。

 天天向上口算本系列答案
天天向上口算本系列答案【题目】某兴趣小组在制取氧气的实验过程中,有如下实验设计方案,该方案的实验目的是:探究氯酸钾和二氧化锰的质量比对反应速率的影响。
编号 | 温度 | 催化剂 | 氯酸钾、二氧化锰的质量比 | 生成1升氧气所需时间/s |
实验Ⅰ | 400℃ | MnO2 | 1:1 | 153 |
实验Ⅱ | 400℃ | MnO2 | 2:1 | 240 |
小芳在实验时,误把氧化铜当作二氧化锰放入加热,结果发现也能较快产生氧气,于是进行如下探究:
猜想Ⅰ:除二氧化锰、氧化铜外,氧化铁(Fe2O3)也可以作氯酸钾分解的催化剂。
(设计实验)按下表进行实验,并测定开始产生气体时的温度(提示:开始产生气体的温度越低,表示反应速度越快)。
实验编号 | 实验药品 | 分解温度(℃) |
① | 氯酸钾 | 580 |
② | 氯酸钾和二氧化锰(质量比1︰1) | 350 |
③ | 氯酸钾和氧化铜(质量比1︰1) | 370 |
④ | 氯酸钾和氧化铁(质量比1︰1) | 390 |
(数据和结论)
(1)由实验_______与实验④对比,证明猜想合理;
(2)实验所用的三种物质中,催化效果最好的是_______。
(反思)
若要证明氧化铁是该反应的催化剂,还需验证它在化学反应前后的________和_______是否改变。
猜想Ⅱ:过氧化钙与水反应可制取氧气。
实验装置 | 实验主要过程 |
| ①检查装置气密性。 ②加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几乎收集不到气体。该装置放置到第二天,集气瓶中只收集到极少量气体,震荡试管后仍有少量细小气泡缓慢放出。 |
实验结论:过氧化钙与水反应可制取氧气。
(分析与反思)
同学们对过氧化钙与水反应的生成物猜想如下:①氢氧化钙和氧气②碳酸钙和氧气
你认为猜想______(填序号)一定是错误的,理由是________,过氧化钙与水反应虽然没有快速收集到大量氧气,但过氧化钙在水中持续、缓慢放出氧气,因此小林认为渔民用过氧化钙做增氧剂。写出此反应的符号表达式________。
(计算)
该兴趣小组的同学们购得用于增氧的过氧化钙产品(杂质不含钙元素),标签如图所示。试计算:

(1)过氧化钙的相对分子质量为_______
(2)该产品中过氧化钙的质量分数至少为______。
(3)小组同学将3g某物质在制得的足量氧气中充分燃烧生成4.4g二氧化碳和1.8g水,求该物质中各元素的原子个数比(写出计算过程)。______